
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
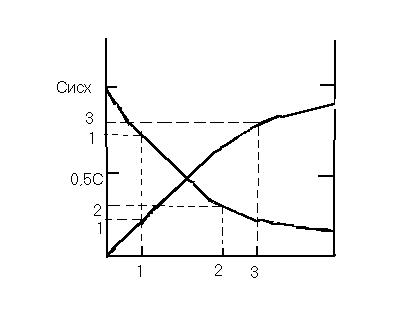
Влияние концентрации на скорость реакции. S - поверхность раздела фаз; - время
|
|
S - поверхность раздела фаз; - время
Ni – количество i – го исходного вещества.
Если V=const во время реакции: 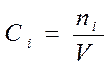
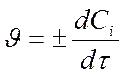
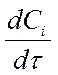 - для исходных веществ - отрицательна Þ
- для исходных веществ - отрицательна Þ 
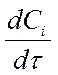 - для продуктов – положительная Þ
- для продуктов – положительная Þ 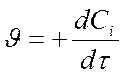
Cкорость реакции зависит от:
1) природы реагирующих веществ,
2) концентрации или давления реагирующих веществ,
3) температуры
4) катализатора
Влияние концентрации на скорость реакции
По теории вероятностей: вероятность одновременного осуществления независимых событий равна произведению вероятностей каждого из них.
Для протекания реакции: A + B→ K + L необходимо:
· одновременное нахождение А и В в определённой точке реакционного пространства;
· удачное их столкновение
Вероятность (ω) нахождения молекулы для каждого из веществ прямо пропорциональна его концентрации:
ω A = α × Cа A, ω B = β × C в B.
Вероятность одновременного нахождения обеих молекул в одной точке пространства, т.е. их столкновения:
ω = ω A × ω B = α × Cа A × β × Cв B.
γ – доля удачных столкновений

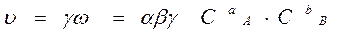

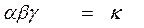
 |

|
|