
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кривые кислотно-основного титрования
|
|
Титрование сильных протолитов. Кривыекислотно-основно-
го титрования (кривые нейтрализации) строят в координатах рН – f, где f – степень оттитрованности, прямо пропорциональная объему добавленного титранта. Для упрощения расчетов пренебрегают изменением объема раствора в ходе титрования. Это упрощение искажает величину рН всего на 0, 1–0, 2 единицы. Пренебрегают также отличием коэффициентов активности от 1. Предполагают, что в растворе есть лишь одно вещество, которое реагирует с титрантом количественно (со 100 %-м выходом продукта). Исходную концентрацию этого вещества (однопротонной сильной кислоты или сильного основания) обозначают символом С. Концентрации ионов Н+ и OH– в разные моменты титрования можно вычислить как функции аргументов f и С, пользуясь уравнениями для расчета рН растворов сильных кислот и сильных оснований (см. раздел 3.3). Полученные формулы приведены в табл. 4.8. Используя их, рассчитаем (табл. 4.9) и построим (рис. 4.8) кривые титрования кислот для разных начальных концентраций.
Кривые титрования сильных оснований рассчитывают аналогичным способом, но они будут не восходящими, как в случае кислот, а нисходящими (см. рис. 4.7Б). При титровании любых сильных протолитов в отсутствие посторонних веществ среда в т.экв. будет нейтральной.
Таблица 4.8
Формулы для расчета кривых титрования сильных протолитов
| Стадия титрования | Степень оттитрованности | Формула для расчета рН | |
| Титрование кислот | Титрование оснований | ||
| до титрования | f = 0 | р С | р Кw – р С |
| до т.экв. | 0 < f < 1 | р С – lg (1– f) | р Кw – р С + lg (1– f) |
| в т.экв. | f = 1 | ½ р Кw | ½ р Кw |
| после т.экв. | f > 1 | р Кw – р С + lg (f –1) | р С – lg (f –1) |
Таблица 4.9
Расчет кривых титрования водных растворов НСl
при разной начальной концентрации
| f | Значение pН | |||
| Общая формула | р С =1 | р С =2 | р С =3 | |
| 0, 5 0, 9 0, 99 0, 999 1, 001 1, 01 1, 1 | р С р С + 0.3 р С + 1 р С + 2 р С + 3 ½ p Кw p Кw – р С – 3 p Кw – р С – 2 p Кw – р С –1 p Кw – р С | 1, 3 | 2, 3 | 3, 3 |
Для расчета границ скачка титрования примем, что допустимо отклонение от т.экв., равное ± 0, 1 %, т. е. ± 0, 001. Если подставить f = 0, 999 и f = 1, 001 в формулы, приведенные в табл. 4.9, окажется, что при титровании сильных кислот высота скачка должна составить:
∆ pН±0, 1% = pН1, 001 – pН0, 999 = p Кw – 2p С – 6. (4.22)
Та же формула определит высоту скачка при титровании сильных оснований.
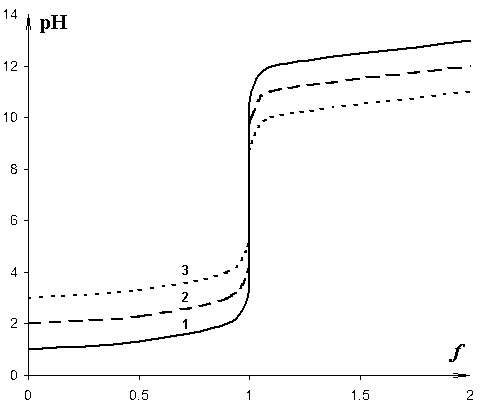
Рис. 4.8. Кривые нейтрализации сильной кислоты:
1 – 0, 1 М; 2 – 0, 01 М; 3 – 0, 001 М
Для водного раствора при комнатной температуре p Кw = 14, и формула (4.22) упрощается:
∆ pН±0, 1% = 8 – 2 рС. (4.23)
При моделировании титрования сильных протолитов при других температурах или в неводных средах в формулу (4.22) надо подставить показатель соответствующей константы автопротолиза, отличающийся от 14. Из (4.22) следует, что чем выше показатель константы автопротолиза растворителя и чем выше концентрация титруемого раствора, тем больше высота скачка и, следовательно, тем точнее окажутся результаты анализа. Напротив, при повышении температуры, когда константа автопротолиза растворителявозрастает, высота скачка и точность результатов титрования уменьшаются.
Для обнаружения к.т.т. с цветным индикатором необходимо, чтобы высота скачка была больше, чем ширина интервала перехода индикатора, которая обычно составляет около двух единиц рН. Из формулы (4.23) следует неравенство: ∆ pН±0, 1% = 8 – 2p С ≥ 2. Решение неравенства относительно p С дает искомый критерий возможности титрования сильных кислот и оснований с погрешностью, по абсолютной величине не превышающей 0, 1 %. Должно выполняться условие pС ≤ 3. Если же считать допустимой погрешность до 1 %, то получаем менее строгий критерий: р С ≤ 4. Таким образом, нижняя граница определяемых концентраций составляет 10–4–10–3 моль/л. Это соответствует экспериментальным данным о погрешностях титрования сильных электролитов при их разной начальной концентрации.
Титрование слабых протолитов. Расчет кривых титрования слабых протолитов будем вести в рамках той же модели, что и для сильных протолитов. Но в этом случае надо будет учитывать не только концентрацию, но и константу кислотности или основности (Кa или Кb) растворенного протолита, поэтому расчеты усложняются.
До начала титрования исследуемыйраствор содержит только слабую кислоту (или слабое основание), рН этого раствора рассчитывают по формулам (3.29) или (3.30). Затем вплоть до точки эквивалентности титруемый раствор содержит одновременно два компонента сопряженной пары. Например, недотитрованную слабую кислоту и продукт реакции – сопряженное с ней слабое основание. Соотношение их концентраций постепенно меняется, кислоты становится все меньше, а сопряженного с ней основания все больше. Но в любой момент, вплоть до т.экв., титруемый раствор представляет собой буферную смесь, рН которой можно рассчитать по формуле (3.40). Последнюю формулу легко преобразовать, связав рН с величиной f (табл. 4.11). Отметим, что вблизи т.экв. (например, при f = 0, 999) вычисление рН по формулам буферных растворов дает несколько неточные результаты, поскольку состав раствора не соответствует допущениям, сделанным при выводе формулы (3.40).
В т.экв. в растворе содержатся лишь продукты реакции, и рН раствора определяется слабым основанием А или слабой кислотой НВ, концентрации которых равны исходной концентрации титруемого протолита С. При титровании слабых протолитов в т.экв. среда не является нейтральной! После достижения т.экв. титруемый раствор содержит смесь однотипных протолитов: слабого (продукта реакции) и сильного (избыточного титранта) в концентрации C (f –1). Сильный протолит подавляет протолиз слабого, и рН раствора за т.экв. определяется именно концентрацией избыточного титранта, как и при титровании сильных протолитов.
Таблица 4.10
Формулы для расчета кривых титрования слабых протолитов
| Стадия титрования | Степень оттитрованности | Формула для расчета рН | |
| Титрование кислот | Титрование оснований | ||
| до начала титрования | f = 0 | 
| p Кw –  (р Кb + р С) (р Кb + р С)
|
| до т.экв. | 0 < f < 1 | 
| 
|
| в т.экв. | f = 1 | p Кw –  (р Кb + р С) (р Кb + р С)
| 
|
| после т.экв. | f > 1 | р Кw – р С + lg (f –1) | р С – lg(f –1) |
Расчетные формулы[1] приведены в табл. 4.10, а на рис. 4.9 показаны результаты, полученные с помощью этих формул, – расчетные кривые титрования кислот с различными величинами p K a. Из рисунка видно, что высота скачка на кривой нейтрализации слабых кислот зависит от величины р K a. Чем слабее кислота (чем больше величина р К а), тем меньше при прочих равных условиях будет высота скачка.
Рис. 4.9. Кривые нейтрализации 0, 1 М растворов кислот разной силы:
1 – соляная кислота; 2 – уксусная кислота (рКа = 4, 8);
3 – синильная кислота (pKa = 9, 2)
Если границы скачка соответствуют значениям f = 0, 99 и 1, 01, то его высота будет приблизительно равна:
∆ pН±1% = pН1, 01 – pН0.99 = (p Кw – р С – 2) – (р Кa + 2) =
= p Кw – р Кa – p С – 4. (4.24)
Для титрования оснований таким же образом получаем:
∆ pН±1% = (p Кw – р Кb – 2) – (р С + 2) = p Кw – р Кb – p С – 4. (4.25)
Очевидно, чем выше показатель константы автопротолиза растворителя, чем сильнее титруемая кислота (или основание) и чем выше концентрация кислоты (или основания), тем больше высота скачка, а значит, выше точность титрования.
Высота скачка должна быть больше ширины зоны перехода индикатора. Поэтому, как и в случае сильных протолитов, критерий возможности титрования слабого протолита с 1 %-й ошибкой можно вывести из условия ∆ pН±1% ≥ 2, подставив его в формулу (4.24). Для водного раствора слабой кислоты получаем искомый критерий в следующей форме:
р Кa + р С ≤ 8. (4. 26)
При p С = 2 критическое значение р Ка равно 6. Это соответствует виду кривых на рис. 4.9. Для синильной кислоты, в отличие от соляной и уксусной, на кривой титрования скачок не заметен. Рассуждая аналогичным образом, получаем, что при титровании водных растворов слабых оснований критерием наличия скачка будет условие
р Кb + р С ≤ 8. (4.27)
Из (4.27) следует, что при рС = 2 оттитровать с погрешностью порядка 1 % можно только те основания, у которых р Кb ≤ 6. При невыполнении условий (4.27) и (4.26) точное кислотно-основное титрование слабых протолитов с индикаторами невозможно. Например, в 0, 1 М водном растворе нельзя оттитровать ортоборную кислоты (р Кa1 = 9, 15), анилин (р Кb = 9, 37), ионы аммония (р Кa = 9, 25) и другие вещества, являющиеся в этой среде очень слабыми протолитами. Титрование таких веществ ведут в среде неводных растворителей либо по методу замещения.
Титрование смесей и многопротонных протолитов. В смешанных растворах сильные кислоты подавляют протолиз более слабых. То же наблюдается в растворах, содержащих смесь оснований разной силы. При добавлении к такой смеси титранта прежде всего оттитровывается более сильный протолит, а уже затем с титрантом реагирует более слабый. Однако число скачков, наблюдаемых на кривой титрования смеси, зависит не только от числа присутствующих протолитов, но и от абсолютных значений соответствующих констант кислотности (основности), а также от их соотношения. Критерием возможности получения раздельных скачков на кривой титрования смеси протолитов является так называемое «правило четырех единиц»:
p Ka 2– p Ka 1≥ 4. (4.28)
Кроме того, для получения скачков титрования, отвечающих каждому из компонентов смеси, должны соблюдаться условия (4.26) или (4.27).
Многопротонные протолиты реагируют с титрантами ступенчато, сначала по первой ступени, затем по второй и т. д., если константы кислотности различаются в соответствии с условием (4.28). При расчете кривых титрования многопротонные протолиты можно рассматривать как смеси разных протолитов. В качестве примера проанализируем возможность ступенчатого титрования такого практически важного вещества, как ортофосфорная кислота. Показатели ступенчатых констант кислотности Н3РО4 составляют 2.15; 7.21; 12.30. Разности Dр Ка превышают 4 единицы, т. е.достаточны для появления трех раздельных скачков, соответствующих реакциям:
Н3PO4 + ОН– ® Н2PO4– + Н2О
Н2PO4– + ОН– ® НPO42– + Н2О
НPO42– + ОН– ® РО43– + Н2О.
Однако гидрофосфат-ион – слишком слабая кислота (р Ка 3= 12, 30). Условие (4.26) не выполняется, третьего скачка на кривой титрования не должно быть. На реальной кривой титрования его действительно нет (рис. 4.10), фосфорная кислота титруется как одноосновная или как двухосновная, в зависимости от используемого индикатора. Титрование Н3РО4 с метиловым оранжевым заканчивается на стадии образования Н2РО4–. С фенолфталеином титрование ведут до НРО42– (вторая точка эквивалентности).
Аналогично при титровании карбонат-ионов (двупротонное слабое основание) сильными кислотами на кривой титрования следует ожидать двух раздельных скачков титрования, соответствующих превращению карбоната в гидрокарбонат, а затем в угольную кислоту.
Раздельное титрование смесей протолитов в водных средах затруднено, поскольку редко выполняются одновременно условия (4.27) или (4.28) и (4.29). В водной среде удается раздельное титрование только двухкомпонентных смесей, содержащих сильную кислоту и умеренно слабую кислоту (НСl + СН3СООН, H2SO4 + Н3РО4) или сильное основание и умеренно слабое основание (NaOH + Na2CO3); титрования проводят с двумя разными индикаторами (рис. 4.11).
При титровании смеси двух сильных кислот, смеси двух одинаково слабых кислот или смеси двух оснований с близкими р Кb двух раздельных скачков на кривой титрования нет. Однако определить концентрацию компонентов таких смесей по отдельности все же вполне возможно. Эти задачи успешно решают, используя дифференцирующие неводные растворители.
Рис. 4.10. Кривая титрования ортофосфорной кислоты щелочью (пунктиром показаны рТ индикаторов)
Рис. 4.11. Кривая титрования смеси карбонат- и гидрокарбонат-ионов раствором HCl
|
|