
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Принцип метода
|
|
Метод нейтрализации основан на проведении кислотно-основных (протолитических) реакций. В ходе такого титрования меняется значение рН раствора. Кислотно-основные реакции наилучшим образом подходят для титриметрического анализа: они протекают по строго определенным уравнениям, без побочных процессов и с очень высокой скоростью, а реакции с участием сильных кислот и оснований – с высокими константами равновесия. Для обнаружения к.т.т. существует удобный и хорошо изученный способ – кислотно-основные индикаторы. Используют и инструментальные методы, особенно для неводных или окрашенных растворов.
Метод нейтрализации включает два варианта – ацидиметрию (титрант – раствор сильной кислоты) и алкалиметрию (титрант – раствор сильного основания). Эти методы, соответственно, применяют для определения оснований и кислот, в том числе ионных и многопротонных. Возможность титрования сильных протолитов определяется их концентрацией; титрование возможно, если Сх > 10-4 М. В ходе такого титрования в водном растворе идет реакция:
H3O+ + OH– ® 2 Н2О.
Титрование слабых кислот и слабых оснований в водных растворах соответствует схемам:
НА + ОН– ® Н2О (алкалиметрия)
В + Н3O+ ® НВ+ + Н2О (ацидиметрия)
Как правило, титрование слабых протолитов возможно лишь в относительно концентрированных растворах (10–1–10–2 М). Необходимо учесть не только концентрацию соответствующего протолита, но и его константу кислотности (К а). Существуют количественные критерии, по которым оценивают возможность титрования слабых протолитов с заданной точностью (формулы 4.26 и 4.27). Вещества, не удовлетворяющие критериям (очень слабые протолиты и некоторые другие соединения), невозможно определить прямым титрованием, но для некоторых из них разработаны методики заместительного титрования. Например, ионы NH4+, обладающие в водном растворе свойствами очень слабой кислоты, напрямую оттитровать не удается. Однако эти ионы количественно реагируют с избытком формальдегида (вспомогательный реагент), образуя уротропин и выделяя эквивалентное количество сильной кислоты:
4 NН4+ + 6 СН2О = (СН2)6N4 + 4Н+ + 6Н2О.
Выделившуюся сильную кислоту титруют стандартным раствором щелочи.
Другим примером может быть определение очень слабой (в водных растворах) борной кислоты. Ее заранее переводят в борноглицериновый эфир, являющийся довольно сильной кислотой, а затем оттитровывают полученный раствор стандартным раствором щелочи.
Примеры практического применения кислотно-основного титрования:
· определение кислотности пищевых продуктов, почв и природных вод (алкалиметрическое титрование водных растворов с индикатором фенолфталеином);
· определение кислотности нефтепродуктов (алкалиметрическое титрование неводных растворов с инструментальным контролем к.т.т.);
· определение карбонатов и гидрокарбонатов в минералах и строительных материалах (ацидиметрическое титрование водных растворов с двумя индикаторами);
· определение азота в солях аммония и в органических веществах (метод Кьельдаля). В этом случае органические азотсодержащие вещества разлагают кипячением с концентрированной серной кислотой в присутствии солей ртути, аммонийный азот отгоняют действием щелочи при нагревании, аммиак поглощают стандартным раствором НСl, взятым в избытке. Затем щелочью титруют непрореагировавшую часть НСl в присутствии индикатора метилового оранжевого. В данной методике используют и принцип замещения, и способ обратного титрования.
Титранты. При ацидиметрическом титровании водных растворовв качестве титрантов берутрастворы сильных кислот (НСl, реже НNO3 или H2SO4). В алкалиметриититранты – растворы NaOH или КОН. Все эти реагенты не обладают свойствами первичных стандартов (твердые щелочи гигроскопичны и всегда содержат примеси карбонатов, сильные кислоты представляют собой не чистые вещества, а растворы с неточно известной концентрацией). Поэтому вначале готовят раствор титранта с приблизительно известной концентрацией, а потом стандартизуют его. Растворы кислот стандартизуют по безводному карбонату натрия Na2CO3 (соде) или по тетраборату натрия Na2B4O7 ·10Н2О (буре). Бура при растворении взаимодействует с водой: В4О72– + 3Н2О = 2Н3ВО3 + 2ВО2–. Образуется метаборат – довольно сильное основание, его титруют кислотой: ВО2– + Н3О+ = Н3ВО3. Молярная масса эквивалента буры равна М (½ Na2B4O7 · 10Н2О) = 190, 71 г/моль; высокая молярная масса эквивалента – преимущество буры как стандарта. Растворы щелочей стандартизуют по гидрофталату калия, который обладает свойствами слабой кислоты:
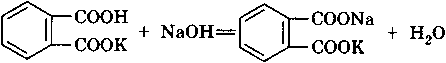
В качестве стандартов используют также бензойную кислоту С6Н5СООН, щавелевую кислоту H2C2O4 · 2H2O и другие слабые органические кислоты (твердые, чистые, устойчивые вещества). Стандартные 0, 1000 М растворы кислот и оснований в лабораториях обычно готовят из фиксаналов. Приготовленный раствор кислоты можно использовать для стандартизации раствора щелочи и наоборот. Стандартизованные растворы кислот устойчивы и могут долго храниться без изменения концентрации. Растворы щелочей менее устойчивы, их рекомендуется хранить в парафинированной или фторопластовой посуде, чтобы не допустить взаимодействия со стеклом. Необходимо учитывать, что растворы щелочей поглощают СО2 из воздуха, при хранении их защищают с помощью трубки, заполненной негашеной или натронной известью.
|
|