
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Изменения концентрации реагирующих веществ
|
|
Уравнение обратимой реакции
FеС13 + 3 KSCN 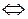 Fe (SCN)3 + 3 KC1. (4.36)
Fe (SCN)3 + 3 KC1. (4.36)
Роданид железа Fe(SCN)3 окрашен в яркий красный цвет. Изменение концентрации Fe(SCN)3 влияет на интенсивность окраски раствора, что позволяет наблюдать, в каком направлении сдвигается равновесие при изменении концентрации реагирующих веществ.
К 5 млразбавленного раствора хлорида железа (III) прилейте 5 млразбавленного раствора роданида калия. В результате получается раствор с характерной красной окраской. Полученный раствор разлейте поровну в четыре пробирки. Первую оставьте для сравнения, во вторую добавьте 2-3 капли насыщенного раствора хлорида железа (III), в третью – 2-3 капли насыщенного раствора роданида калия, в четвертую – немного твердого хлористого калия. Содержимое второй и третьей пробирок перемешайте, четвертую сильно встряхивайте.
Что наблюдается в каждой пробирке? Рассчитайте Δ Н  , Δ G
, Δ G  (табл.П.1.7), составьте выражение константы равновесия для данной реакции и объясните результаты опыта.
(табл.П.1.7), составьте выражение константы равновесия для данной реакции и объясните результаты опыта.
Вариант 2. Влияние рН среды на смещение химического
|
|