
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Работа 2. Изучение кинетики реакции разложения мочевины в водных растворах методом измерения электропроводности
|
|
В данной работе одним из электрохимических методов следует изучить кинетику реакции разложения мочевины в водных растворах, аналитически и графически определить среднюю константу скорости и энергию активации реакции.
Известно, что мочевина в водных растворах при температуре 500С и выше разлагается. Первым этапом разложения является ее изомеризация – превращение в цианит аммония с последующим переходом из цианита в карбонат и далее – в аммиак и углекислоту:

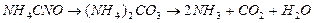
Реакция превращения цианита в карбонат протекает практически необратимо и по мономолекулярному механизму. В результате образования карбоната электропроводность раствора со временем растет. Это позволяет измерять скорость реакции, поскольку приращение электропроводности можно считать пропорциональным концентрации конечного продукта.
Как уже указывалось, исследуемая реакция является реакцией первого порядка, поэтому расчет константы скорости реакции ведется по уравнению
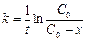
где 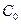 – начальная концентрация мочевины; х – концентрация мочевины, прореагировавшей к данному моменту времени; (
– начальная концентрация мочевины; х – концентрация мочевины, прореагировавшей к данному моменту времени; ( ) – концентрация мочевины, не прореагировавшей к данному моменту времени; t – время данного замера от начала реакции.
) – концентрация мочевины, не прореагировавшей к данному моменту времени; t – время данного замера от начала реакции.
Принимаем, что увеличение электропроводности во времени пропорционально количеству образовавшегося карбоната или количеству прореагировавшей мочевины.
Обозначим: 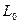 - электропроводность раствора в момент начала реакции;
- электропроводность раствора в момент начала реакции; 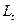 – электропроводность в данный момент времени t;
– электропроводность в данный момент времени t;  – электропроводность, соответствующая последнему измерению, когда процесс разложения мочевины полностью закончен.
– электропроводность, соответствующая последнему измерению, когда процесс разложения мочевины полностью закончен.
Тогда, 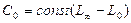 ,
,
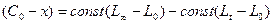 .
.
Таким образом, расчеты можно проводить по уравнению
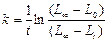
За величину 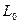 принимают первое измеренное значение электропроводности.
принимают первое измеренное значение электропроводности.
Вычислив константу скорости реакции для каждого момента времени, определяют ее среднее значение и сравнивают с величиной k, полученной графическим путем по тангенсу угла наклона прямой к оси t на графике 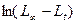 от t.
от t.
По двум константам скорости, при двух температурах, рассчитывают величину энергии активации для данной реакции.
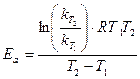
|
|