
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Скорость химической реакции
|
|
ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ
Скорость химической реакции
Химическая кинетика (от греч. Kinetikos - относящийся к движению) - раздел физической химии, изучающий химическую реакцию, как процесс, протекающий во времени, механизм этого процесса, его зависимость от условий осуществления.
Одним из важнейших понятий химической кинетики является скорость реакции. Она определяется изменением количества какого-либо из реагирующих веществ (или продуктов реакции) в единицу времени в единице объема. В частном случае, например, когда реакция происходит в растворе, объем реакционной смеси не меняется. Тогда изменение количества вещества в единице объема есть изменение концентрации. Соответственно, скорость реакции в растворе определяется изменением концентрации вещества в единицу времени.
Исходные вещества вступают в реакцию (а продукты образуются) в определенных соотношениях, которые определяются стехиометрическими коэффициентами. Поэтому изменение концентрации для разных реагентов (или продуктов) за один и тот же интервал времени в одной и той же реакции может быть различным. В связи с этим различают понятия «скорость химической реакции» и «скорость изменения концентрации».
Скорость изменения концентрации (r) есть производная по времени (t) концентрации (C) какого-либо из реагирующих веществ (или продуктов реакции):
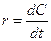
Очевидно, что скорость изменения концентрации может быть различна по величине для разных веществ, участвующих в реакции. К тому же она противоположна по знаку для реагентов и продуктов реакции.
Скорость химической реакции (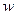 ) по определению есть величина положительная. Она не должна зависеть от того, по какому из реагирующих веществ (или продуктов) ее определяют.
) по определению есть величина положительная. Она не должна зависеть от того, по какому из реагирующих веществ (или продуктов) ее определяют.
Запишем уравнение химической реакции. Например:
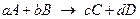
Или в общем виде:
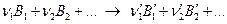
Формально рассматривая уравнение как математическое, перенесем все слагаемые из левой части в правую. Получим:
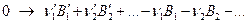
Или в более общем виде:
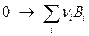
В уравнении коэффициент 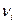 считается алгебраически положительным (
считается алгебраически положительным (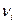 > 0), если компонент
> 0), если компонент 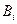 относится к продуктам, и алгебраически отрицательным (
относится к продуктам, и алгебраически отрицательным (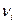 < 0), если компонент
< 0), если компонент 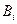 относится к исходным веществам. Теперь скорость химической реакции (
относится к исходным веществам. Теперь скорость химической реакции (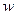 ) можно определить следующим уравнением:
) можно определить следующим уравнением:
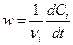
где 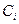 - концентрация вещества
- концентрация вещества 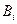 .
.
Значение, определяемое по уравнению, всегда положительно и не зависит по величине от выбора 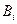 . В частном случае для реакции уравнение может быть записано следующим образом:
. В частном случае для реакции уравнение может быть записано следующим образом:
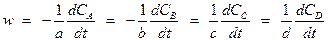
В общем случае скорость химической реакции не постоянна, а зависит от времени. Поэтому величину, определяемую по уравнениям и, часто называют истинной скоростью реакции или мгновенной скоростью реакции. Практически скорость реакции можно определить, поделив разность концентраций в моменты времени 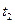 и
и 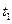 на интервал времени
на интервал времени 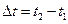 . Определенная таким образом скорость называется средней скоростью (
. Определенная таким образом скорость называется средней скоростью (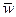 ). Она равна мгновенной скорости только при
). Она равна мгновенной скорости только при 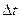 стремящемся к нулю (или если мгновенная скорость не зависит от времени).
стремящемся к нулю (или если мгновенная скорость не зависит от времени).
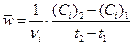
Кинетическая кривая – это зависимость концентрации какого-либо из реагентов (или продуктов реакции) от времени. Именно эта зависимость обычно используется при экспериментальном определении скорости реакции. На рис.1 приведены примеры кинетических кривых для реагентов и продуктов. Из кинетической кривой можно определить не только среднюю скорость, но и мгновенную. Мгновенная скорость в точке 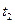 , определяемая графическим способом по рис.1, равна отношению катетов треугольника, образуемого касательной, проведенной к кинетической кривой в этой точке, и отрезками координатных осей от их пересечения до пересечений с касательной.
, определяемая графическим способом по рис.1, равна отношению катетов треугольника, образуемого касательной, проведенной к кинетической кривой в этой точке, и отрезками координатных осей от их пересечения до пересечений с касательной.
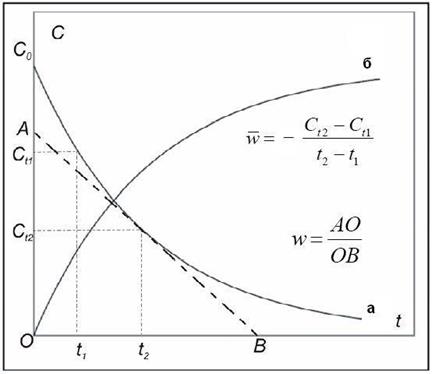
Рис. 1. Кинетические кривые: а – изменение концентрации одного из реагирующих веществ; б – изменение концентрации одного из продуктов реакции. Прямая AB – касательная к кинетической кривой (а) в точке t2.
|
|