
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энергия активации
|
|
Для того чтобы произошла реакция, необходимо преодолеть отталкивание электронных оболочек молекул и разорвать или ослабить связи между атомами. На это надо затратить определенную энергию.
Энергия активации в элементарных реакциях – минимальная энергия реагентов (атомов, молекул и др. частиц), достаточная для того, чтобы они вступили в химическую реакцию, т. е. для преодоления барьера на поверхности потенциальной энергии, отделяющего реагенты от продуктов реакции.
Потенциальный барьер – максимум потенциальной энергии, через который должна пройти система в ходе элементарного акта химического превращения.
В ходе реакции вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется активированным комплексом или переходным состоянием. Именно для его образования необходима энергия активации (рис. 4, 5).
Число частиц, входящих в активированный комплекс, определяет молекулярность данной стадии реакции.
Неустойчивый активированный комплекс существует очень короткое время (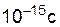 ). Он распадается с образованием исходных веществ или продуктов реакции.
). Он распадается с образованием исходных веществ или продуктов реакции.
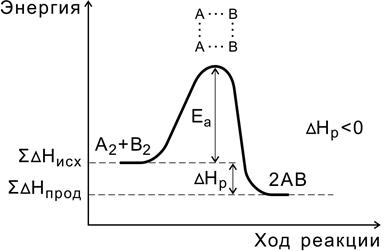
Рис. 4. Энергетическая диаграмма экзотермической реакции
Переходное состояние возникает в ходе как прямой, так и обратной реакций (рис. 6). Разность энергий активации прямой и обратной реакций равна изменению внутренней энергии (тепловому эффекту) реакции
D Н р = Е а(пр) - Е а (обр).
В макроскопической химической кинетике энергия активации – параметр Е a, входящий в уравнение Аррениуса (2.14). В общем случае сложных реакций параметр Е a является функцией энергий активации отдельных стадий, и определяемая энергия активации называется эффективной (эмпирической, кажущейся).
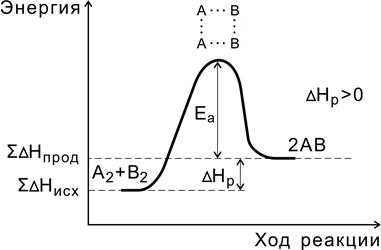
Рис. 5. Энергетическая диаграмма эндотермической реакции
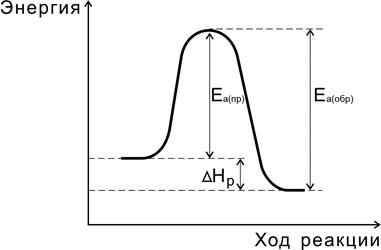
Рис.6. Соотношение между энергиями активации прямой
и обратной реакций и теплового эффекта
|
|