
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кинетические кривые по реагенту (А) и продукту (D) приведенной реакции
|
|
 Средняя скорость химической реакции - величина приближенная. Истинная скорость является более объективной характеристикой реакции, но и она неудобна для сравнения скоростей различных реакций между собой вследствие ее изменяемости во времени. Поэтому ни истинная, ни средняя скорости реакции не используются в качестве ее кинетических характеристик; такой величиной является константа скорости реакции (разд. 5.2.2).
Средняя скорость химической реакции - величина приближенная. Истинная скорость является более объективной характеристикой реакции, но и она неудобна для сравнения скоростей различных реакций между собой вследствие ее изменяемости во времени. Поэтому ни истинная, ни средняя скорости реакции не используются в качестве ее кинетических характеристик; такой величиной является константа скорости реакции (разд. 5.2.2).
Каждая химическая реакция протекает по определенному механизму. Механизм реакции описывает ее путь, т. е. последовательность элементарных актов взаимодействия реагентов, через которые она протекает. Реакции, по их механизму, подразделяются на простые и сложные.
Простые, или элементарные, реакции - это реакции, протекающие в одну стадию.
Для таких реакций химическое уравнение полностью отражает, какие частицы и в каких соотношениях непосредственно участвуют в элементарном акте реакции. Например:
а) I2 → 2I- б) Н+ + ОН- → Н2О в) О2 + О → О3
Большинство химических и все биохимические реакции являются сложными.
Сложные реакции - это реакции, протекающие в несколько стадий, каждая из которых является простой реакцией.
Например, реакция Н2 + Cl2 → 2НС1 является сложной. Обнаружено, что она протекает через множество стадий (разд. 5.4).
Для сложных реакций общее химическое уравнение отражает только количественную характеристику процесса в целом и не учитывает, какие частицы и в каких соотношениях участвуют в отдельных стадиях процесса. Стадии сложных реакций могут протекать:
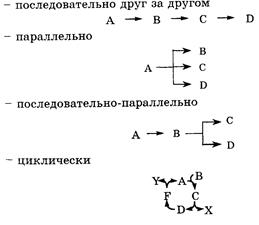
В соответствии с этим сложные реакции подразделяются на последовательные, параллельные, последовательно-параллельные и циклические. Большинство биохимических реакций являются последовательно-параллельными или циклическими многостадийными процессами.
В сложных реакциях скорости отдельных стадий могут резко отличаться друг от друга. В этих случаях скорость сложной реакции в целом будет определяться скоростью наиболее медленной стадии, называемой скоростьопределяющей или лимитирующей стадией. Поэтому при изучении механизма реакции по кинетическим данным прежде всего определяют кинетические характеристики ее лимитирующей стадии.
|
|