
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическая кинетика
|
|
Химическая кинетика – учение о скорости и механизме химической реакции, а также о факторах (концентрации, температуре, давлении, катализаторах и т.д.), влияющих на скорость химической реакции.
Различают кинетику гомогенных реакций, протекающих равномерно во всем объёме, заполненном веществами, и кинетику гетерогенных реакций, идущих только на некоторых пограничных поверхностях – на границе раздела фаз. Так как в гетерогенной реакции участвуют вещества, находящиеся в разных фазах, то одновременно с химической реакцией осуществляются процессы через стадии адсорбции или диффузии. Фазой называется однородная часть системы одинаковая по составу, свойствам в каждой точке и отделённая от других частей поверхностью раздела.
Скорость химических реакций определяется по изменению концентрации либо одного из исходных веществ, либо одного из продуктов реакции в единицу времени. Средняя скорость реакции вычисляется по формуле
 , (1)
, (1)
где 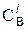 – начальная концентрация вещества В, выраженная в моль/л, в момент времени t1;
– начальная концентрация вещества В, выраженная в моль/л, в момент времени t1; 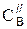 – его концентрация к моменту времени t2.
– его концентрация к моменту времени t2.
Время может быть выражено в секундах, минутах, часах в зависимости от скорости протекания реакций. Скорость реакции всегда положительна. Знак минус имеет DСв/Dt, когда скорость реакции определяется по изменению концентрации одного из исходных веществ, а знак плюс, если скорость реакции определяется по изменению концентрации одного из продуктов реакции.
Пример 1. Рассчитайте среднюю скорость реакции
2KJ + Вr2 = 2КВr + J2,
протекающую в водном растворе, если исходная концентрация Вr2 составляла 0, 4 моль/л, а через 2, 5 минуты стала 0, 25 моль/л.
Решение. Средняя скорость реакции рассчитывается по уравнению (1), в которое подставляются данные, приведенные в задаче
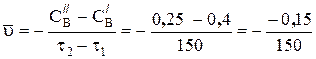 = 0, 001 моль× л–1× с–1.
= 0, 001 моль× л–1× с–1.
Скорость реакции зависит от концентрации и природы реагирующих веществ, температуры, катализаторов и других факторов.
1.1. Влияние концентрации на скорость химической реакции.
Закон действующих масс
Зависимость скорости реакции от концентрации выражается законом действующих масс (ЗДМ): скорость химической реакции при постоянных объёме и температуре в каждый момент времени пропорциональна произведению концентрации реагирующих веществ, возведённых в степени, равные их стехиометрическим коэффициентам. Для реакции, представленной в общем виде:
2А + В = А2В
ЗДМ в математической форме для прямой реакции записывается в виде кинетического уравнения:
u = k 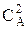 CВ, (2)
CВ, (2)
где k – константа скорости реакции (зависит от природы реагирующих веществ, температуры, катализаторов и т.д. и не зависит от концентрации веществ).
ЗДМ применим для гомогенных и гетерогенных систем. В последнем случае, если самой медленной стадией процесса является собственно химическая реакция.
ЗДМ строго справедлив только для простых химических реакций, протекающих в одну стадию, т.е. осуществляющихся путём непосредственного перехода реагирующих молекул в продукты реакции.
Число молекул, участвующих в реакции, определяет молекулярность реакции. По этому признаку реакции делятся на одно-, двух- и трёхмолекулярные. Реакции более высокой молекулярности мало вероятны, так как возможность одновременного столкновения четырёх и более молекул практически исключена. Если в реакции участвуют больше трёх молекул, то процесс, как правило, протекает в две и большее число стадий. Такие реакции являются сложными. Скорость сложной реакции определяется скоростью наиболее медленной стадией процесса.
Каждому типу реакции соответствует своё кинетическое уравнение (см. уравнение 2). Сумма показателей степеней при концентрациях в таком уравнении определяет общий порядок реакции. Так, согласно уравнению (2), общий порядок одностадийной трёхмолекулярной реакции равен трём. Порядок и молекулярность реакции совпадают только для простых реакций, протекающих в одну стадию в соответствии со стехиометрическим уравнением. В подавляющем большинстве случаев, а это сложные реакции, молекулярность и порядок не совпадают. Объясняется это тем, что стехиометрическое уравнение описывает процесс в целом и не отражает истинного механизма реакции, протекающей, как правило, через ряд стадий. Для сложных реакций порядок реакции находят по кинетическому уравнению медленной стадии процесса.
Порядок реакции по веществу определяется показателем степени при концентрации этого вещества в кинетическом уравнении.
Для гомогенных реакций в кинетическом уравнении учитываются концентрации всех реагирующих веществ, для гетерогенных – только концентрации жидких или газообразных веществ.
Скорость гетерогенных реакций, с участием твёрдых веществ, зависит от степени их измельчения (степени дисперсности). По этой причине порошки значительно быстрее реагируют, чем крупные куски.
Для гетерогенных реакций, протекающих на границе твёрдое вещество – газ, твёрдое вещество – жидкость, скорость реакции изменяется в зависимости от концентрации газа или жидкости, так как концентрация твёрдого вещества (число молей в единице объёма) постоянна. Например, в системе твёрдое вещество – газ столкновения между молекулами газа и твердого вещества могут происходить лишь на поверхности раздела фаз. Таким образом, масса твёрдой фазы не влияет на скорость реакции. Так, при одинаковой степени раздробленности угля скорость гетерогенной реакции
С(т) + О2(г) = СО2(г)
будет пропорциональна концентрации кислорода: u = k 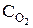 .
.
|
|