Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Катализ. Особенности каталитических процессов
|
|
Понятие катализа было введено Берцелиусом (1836 г). Катализ - изменение скорости реакции в присутствии некоторых веществ, называемых катализаторами, которые сами в процессе реакции остаются неизменными и по составу и по количеству.
Различают положительный и отрицательный катализ. В настоящее время до 70% химических реакций - это процессы каталитические. Катализаторы сильно влияют на скорость реакции, увеличивая ее в случае положительного катализа и понижая в случае отрицательного.
Вещества, уменьшающие скорость реакции, называется ингибиторами. Если катализатором является один из продуктов реакции, то такая реакция называется автокаталитической. Например, восстановление FeO водородом катализируется железом: FeO + H2 → Fe + H2O.
Катализаторам свойственны следующие особенности:
1. Катализатор не влияет на положение термодинамического равновесия, т.е. на величину константы равновесия, а только ускоряет достижение состояния равновесия.
2. Катализаторы обладают избирательностью (селективностью) действия, т.е. каждый катализатор ускоряет лишь определенные реакции:
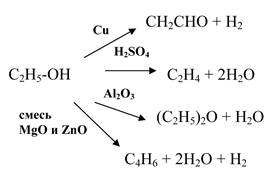
Но существуют универсальные катализаторы, например AlCl3 - катализатор хлорирования, изомеризации, алкилирования, полимеризации.
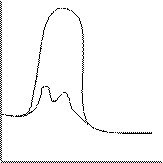
3. Катализатор приводит к уменьшению энергии активации катализируемой реакции по сравнению с реакцией без катализатора. Так как, энергия активации входит в показатель степени в уравнении Аррениуса, то даже небольшое ее понижение ведет к сильному увеличению скорости.
Для объяснения этого используется теория промежуточных соединений Аррениуса (1889 г): в ходе реакции образуется неустойчивое промежуточное соединение катализатора с реагирующими веществами (интермедиат), которое затем распадается с регенерацией катализатора.
Рассмотрим реакцию: А + В → АВ,
Е1 - энергия активации реакции в отсутствии катализатора.
В присутствии катализатора (К) процесс протекает по стадиям (катализатор не участвует в стехиометрическом уравнении реакции):
А + К → АК (интермедиат, энергия активации - Е2),
АК + В → АВ + К (энергия активации - Е3),
E1 > E2 + E3.
Уравнение Аррениуса: k = Ae-E/RT.
| 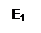
| ||||||||||||||
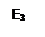 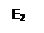
| |||||||||||||||
| |||||||||||||||
Рис. 5.9. Уменьшение энергии активации с помощью катализатора
Пример, CH3COH (ацетальдегид) «CH4 + CO.
Энергия активации данной реакции: Е=45500 кал/моль. В присутствии йода реакция идет в 1000 раз быстрее (E=32500 кал/моль).
CH3CHO + J2 → CH3J + HJ + CO
CH3J + HJ → CH4 + J2
CH3CHO + J2 → CH4 + CO + J2
4. Ускорение реакции пропорционально концентрации катализатора.
5. Физическое и химическое сродство катализатора к реагентам.
Для реакций гидрирования и дегидрирования используют Pt, Pd, Ni, которые обладают специфической адсорбцией водорода. Для реакции гидратации и дегидратации используют Al2O3, который склонен к образованию гидратов. Для реакций окисления используют серебро, медь, склонные к образованию нескольких степеней окисления.
|
|