
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Исследование гетерогенной каталитической реакции
|
|
Цель работы: определение константы уравнения Фроста-Баландина и энергии активации реакции дегидратации этилового спирта в присутствии окиси алюминия по скорости образования этилена при различной температуре и скорости подачи спирта.
Порядок выполнения работы.
1.Собирают установку согласно схеме (рис. 1) и проверяют ее герметичность. Включают электропечь(3) в сеть и доводят температуру в реакторе (2) до заданной. За температурой следят по показанию милливольтметра (4), к которому подсоединена термопара; горячий спай термопары вставляется в карман реактора. Регулируют температуру посредством автотрансформатора(5).
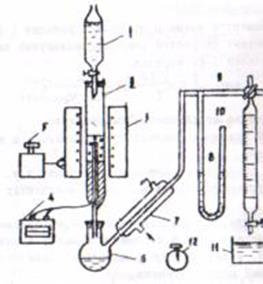 Обозначения:
Обозначения:
1 – бюретка сырьевая;
2 – реактор о AI2О3;
3 – электропечь;
4 – милливольтметр;
5 – автотрансформатор;
6 – колба приемная;
7 – холодильник;
8 – манометр;
9 – трехходовой кран;
10 – бюретка для сбора этилена;
11 – стакан с водой;
12 - секундомер
Рис. 1. Схема установки
2. После установления постоянной температуры заполняют спиртом или раствором спирта бюретку (1) и водой бюретку (10). Затем подают воду в холодильник (7) и начинают опыт.
3. С помощью краника и секундомера устанавливают и поддерживают постоянной скорость подачи спирта из бюретки (1) в реактор (2). Постоянство давления в установке контролируют по манометру (8) и регулируют, меняя скорость выпускания воды из бюретки (10) таким образом, чтобы сохранялось нулевое положение уровня жидкости в манометре. При этом кран (9) должен соединить бюретку с системой, а не с атмосферой. Через каждые 2 минуты записывают уровни жидкостей в бюретках (1) и (10) и температуру. Опыт проводят в течение 10 - 20 минут.
4. Подачу спирта прекращают, вновь заполняют водой бюретку (10) и проводят опыт при других условиях. Всего проводят 3-4 опыта при различных температурах (в диапазоне 300-4000С) и постоянной скорости подачи спирта или при постоянной температуре и различной скорости подачи спирта (соответствующей 1 капле за 1, 2, 3 и т.д. секунд).
Экспериментальные данные заносят в таблицу1
№ опыта……. Условия опыта…………
Таблица1
| Время по часам | Продолжитель-ность опыта, мин. | Температура, 0С | Скорость подачи спирта, сек/1 капля | Уровень в бюретке I, мл | Уровень в бюретке IO, мл |
Обработка результатов
1. Определяют число молей спирта (nc), прошедшего через реактор в одном опыте:
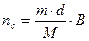 г – моль, (1)
г – моль, (1)
где m – число мл спирта или водно-спиртовой смеси;
d – плотность спирта или водно-спиртовой смеси;
B – весовая доля спирта в смеси.
1. Определяют число молей этилена(nэ), выделившегося в одном опыте:
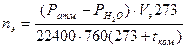 – г-моль, (2)
– г-моль, (2)
где Ратм. – барометрическое давление, мм рт. ст.;
РН2О – упругость паров воды при комнатной температуре
(tкомн.); при tкомн.= 20-250С
РН2О = 18-24 мм рт. ст. (см. Справочник Мищенко, стр. 64);
Vэ – число мл этилена, выделившегося в опыте.
2. Рассчитывают степень превращения спирта (y):
у=nэ/nc (3)
3. Определяют объемную скорость подачи спирта (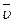 )
)
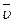
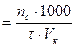 , ммоль/мин. (4)
, ммоль/мин. (4)
Где t – продолжительность опыта, мин.;
Vк – объем катализатора, мл.
Результаты расчета заносят в таблицу 2.
Таблица2
| № п/п | nc, г-моль | nэ, г-моль | у | 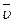 ,
ммоль/мин. ,
ммоль/мин.
|  у у
| 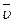 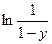
|
| 1. 2. 3. … |
4. На основании экспериментальных данных строят график (рис. 2) в координатах «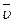
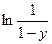 –
– 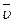 у». Находят константы a и β уравнения Фроста-Баландина:
у». Находят константы a и β уравнения Фроста-Баландина:
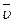
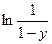 =a + β
=a + β 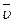 у, (5)
у, (5)
где a – постоянная, прямо пропорциональная общей поверхности катализатора и константе скорости поверхностной реакции;
β – постоянная, характеризующая адсорбционные коэффициенты вещества.


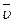
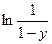
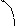 Ө tgӨ =β
Ө tgӨ =β
 |  |  | |||||
 |
a
 |
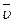 у
у
Рис. 2. Графическая зависимость в координатах уравнения Фроста-Баландина
6. По значениям для различных температур Т1 и Т2, 0К вычисляют кажущуюся энергию активации реакции:
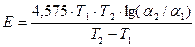 , кал. (6)
, кал. (6)
Литература
1. Белик В.В. Физическая и коллоидная химия. - М.: Академия, 2006.
2. Еремин В.В., Каргов С.И., Успенская И.А. и др. Основы физической химии. Теория и задачи. – М: Издательство «Экзамен». 2005.
3. Шершавина А.А. Физическая и коллоидная химия. Методы физико-химического анализа: Учебное пособие / А.А. Шершавина.- М.: Новое знание, 2005.
4. Стромберг А.Г., Семченко Д.П. Физическая химия.-М.: Высш.шк. 2001.
5. Гельфман М.И. Практикум по физической химии. – СПб.: Издательство «Лань». 2004.
|
|