
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние температуры на скорость химической реакции
|
|
Скорость химической реакции увеличивается с повышением температуры. Приблизительно оценить влияние температуры на скорость реакции можно по правилу Вант-Гоффа:
при повышении температуры на каждые 10 градусов скорость реакции увеличивается в 2¸ 4 раза.
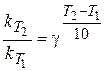 ,
,
где g - температурный коэффициент Вант-Гоффа.
k (T1) и k (T2) – константы скорости реакции при температурах Т1 и Т2 .
Для биологических процессов важен определенный температурный интервал, вне которого процесс прекращается. В этом интервале увеличение температуры активизирует протекание жизненно важных процессов до оптимального, а последующее повышение температуры быстро снижает скорость процесса вплоть до прекращения жизнедеятельности организма. Это связано с необратимой тепловой денатурацией белков биологических тканей, а также с инактивацией ферментов (биологических катализаторов).
Более точно зависимость скорости реакции от температуры выражается уравнением Аррениуса. Уравнение Аррениуса в дифференциальной форме:
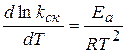
где kск константа скорости реакции
Т- температура
R – универсальная газовая постоянная: R=8, 314 Дж/моль∙ К
 Еа - энергия активации.
Еа - энергия активации.
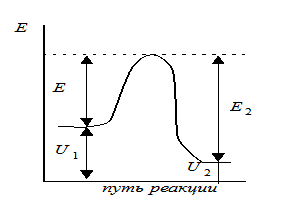
Энергия активации - та избыточная энергия (по сравнению со средней энергией молекул), которой должны обладать сталкивающиеся молекулы, чтобы быть способными к химической реакции (рис.)

Активация вызывается повышением температуры, действием электрического поля, действием квантов света и т.д. Энергия активации Еа постоянна в данном температурном интервале и определяется механизмом реакции. Её можно определить графически по уравнению Аррениуса в линейной форме.
ln k = 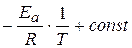 или к=к0е-(Ea/RT).
или к=к0е-(Ea/RT).
где k0 – предэкспоненциальный множитель.
В координатах ln k – 1/ T данное уравнение представляет собой прямую линию с угловым коэффициентом, равным 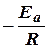
Определенный интеграл в интервале температур Т 1 ¸ Т 2 даёт следующее выражение:
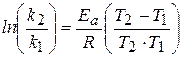 .
.
Это уравнение дает возможность, зная энергию активации и константу скорости при одной температуре, определить константу скорости при другой температуре. Или же, зная величины констант скоростей при двух температурах, можно рассчитать значение энергии активации.
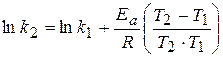
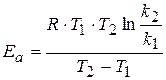 .
.
|
|