
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Реакция с цинк-уранилацетатом.
|
|
А) Специфической реакцией на ион натрия является кристаллоскопическая реакция с цинк-уранилацетатом:
Na+ + Zn[(UO2)2(CH3COO)8] + CH3COOH → NaZn[(UO2)2(CH3COO)9]↓ + H+
Эта реакция является самой чувствительной из всех известных осадочных реакций на ион натрия. Кроме того, она специфична для натрия. Присутствие 10-20-кратных количеств любых катионов не мешает определению натрия. Предел обнаружения натрия — 0, 1 мкг.
Выполнение реакции. На предметное стекло помещают каплю раствора, содержащего ионы натрия. Рядом помещают каплю раствора реагента и стеклянной палочкой соединяют капли. Дают постоять и рассматривают образовавшиеся кристаллы под микроскопом.

Б) Натрий цинкуранилацетат обладает яркой флуоресценцией зеленого цвета. При содержании натрия более 10 мкг свечение наблюдается сразу же после прибавления реагента, при меньших содержаниях натрия свечение становится заметным лишь через 1—4 мин. Флуоресценция обусловлена наличием иона уранила (UO2) 2+, а интенсивность свечения зависит от агрегатного состояния его соединений. Так, цинк-уранилацетат в водном растворе очень слабо флуоресцирует, а в твердом состоянии обладает яркой желто-зеленой флуоресценцией. Поэтому реакцию на натрий лучше проводить капельным методом на предметном стекле, а не на фильтровальной бумаге. Адсорбируясь на ней, цинкуранилацетат начинает флуоресцировать, что мешает обнаружению натрия.
Предел обнаружения натрия – 0, 03 мкг. Реакция довольно селективна. Аналогичную реакцию дает лишь литий
Выполнение реакции. На предметное стекло помещают к аплю раствора, содержащего ионы натрия, и каплю уксуснокислого раствора цинкуранилацетата. При облучении ультрафиолетовым светом (УФС-3 или УФС-6) наблюдают зеленое свечение.
3.2. Реакция с гексагидроксостибатом (V) калия, K[Sb(OH)6]. Гексагидроксостибат (V) калия с ионами Na+ в нейтральной или слабощелочной среде (рН = 7 - 8) при охлаждении образует белый кристаллический осадок Na[Sb(OH)6] - гексагидроксостибат (V) натрия:
Na+ + [Sb(OH)6]– ® Na[Sb(OH)6] ¯
Осадок Na[Sb(OH)6] растворим в горячей воде и частично в щелочах.
Выполнению реакции мешают ионы аммония. Соли аммония, подобно кислотам, выделяют аморфный осадок:
[Sb(OH)6]– + Н+ ® HSbO3 ¯ + 3H2O
Кроме того, выполнению реакции мешают ионы Li+ и Mg2+.
Выполнениереакции: возьмите в пробирку 5 - 6 капель раствора любой соли натрия и при помощи универсального индикатора определите рН среды. Если среда кислая (рН< 7), нейтрализуйте ее, прибавляя по каплям КОН. Если среда щелочная (рН> 7), прибавьте по каплям раствор уксусной кислоты (СН3СООН) до нейтральной реакции (рН» 7). К этому раствору прилейте 2-3 капли раствора K[Sb(OH)6]. Пробирку охладите под струей холодной водопроводной воды. Потирание стенок пробирки стеклянной палочкой ускоряет процесс выпадения белого кристаллического осадка соли Na[Sb(OH)6].
Запишите наблюдения и уравнение реакции в молекулярном и ионно-молекулярном виде.
3.2. Окрашивание пламени - фармакопейная реакция. Соли натрия окрашивают пламя газовой горелки в желтый цвет. Эта проба весьма характерна. Нужно иметь в виду, что реакция окрашивания пламени летучими солями натрия очень чувствительна (открываемый минимум – 0, 00001 мкг натрия в пробе). В таких дозах натрий присутствует практически везде в пыли, воде (извлекается из стекла), поэтому о присутствии натрия в исследуемом препарате можно делать заключение лишь при наличии яркого и не исчезающего в течение нескольких секунд желтого окрашивания пламени.
Выполнение реакции: чистую нихромовую проволоку опустите в насыщенный раствор соли натрия или в сухую соль натрия и затем внесите её в пламя горелки. Запишите наблюдения в тетрадь.
4. Открытие ионов бария
4.1. Реакция с серной кислотой - фармакопейная реакция. Серная кислота и растворимые сульфаты с ионами бария Ва2+ образуют белый кристаллический осадок, нерастворимый в минеральных кислотах:
Ba2+ + SO42- ® ¯ BaSO4
Выполнение реакции: поместите в пробирку 1-2 капли раствора соли бария и добавьте к нему 2-3 капли 1 М раствора H2SO4.
Запишите наблюдения и уравнение реакции в молекулярном и ионно-молекулярном виде.
4.2. Реакция с хроматом калия, K2CrO4 или дихроматом калия, K2Cr2O7. Хромат калия с ионами бария Ва2+ при рН = 4-5 образует желтый осадок хромата бария ВаCrO4:
Ba2+ + CrO42- ® ¯ ВаCrO4
Хромат бария растворим в сильный кислотах (кроме H2SO4), но нерастворим в уксусной кислоте. При проведении реакции в уксуснокислой среде определению иона бария не мешают ионы Ca2+, так как осадок CaCrO4 не образуется.
Предел обнаружения бария — 0, 15 мг. Ионы Hg(I, II), Ag+, Pb2+, Bi3+ и Fe3+ мешают обнаружению бария, так как образуют окрашенные хроматы. Ионы Са2+ и Sr2+ при рН< 7 не образуют осадков с К2Сr2О7 и не мешают обнаружению бария. Эта реакция используется для отделения Ва от Sr и Са. Предел обнаружения бария — 0, 08 мкг.
Выполнение реакции: смешайте в пробирке по 5 капель растворов хлорида бария и хромата калия. Полученный осадок разделите на две пробирки. В первую пробирку с осадком добавьте 2-3 мл 2 М раствора HCl, а в другую - 2-3 мл 2 М раствора СН3СООН.
Запишите наблюдения и уравнение реакции в молекулярном и ионно-молекулярном виде.
4.3. Окрашивание пламени - фармакопейная реакция. Соли бария окрашивают пламя газовой горелки в желто-зеленый цвет.
Выполнение реакции: чистую нихромовую проволоку опустите в насыщенный раствор соли бария или в сухую соль и затем внесите её в пламя газовой горелки. Запишите наблюдения в тетрадь.
5. Открытие ионов кальция
Определение кальция по ГФXI осуществляют 2 методами.
5.1. Реакция с оксалатом аммония, (NH4)2C2O4. Весьма специфической реакцией на ион кальция является реакция образо- вания белого осадка оксалата кальция:
Ca2+ + (NH4)2C2O4 → CaC2O4↓ + 2NH4+
Осадок оксалата кальция нерастворим в уксусной кислоте и растворе аммиака, но растворим в минеральных кислотах. Этой качественной реакции на ион кальция мешают лишь ионы бария и стронция. С помощью этой реакции можно открыть кальций в препаратах, растворимых в воде, таких, как кальция хлорид, кальция глюконат, кальция добезилат, кальция лактат и др. В препаратах, очень малорастворимых или практически нерастворимых в воде (бепаск, гипс жженый), открыть кальций непосредственно с помощью этой реакции нельзя. Это можно сделать только после предварительной обработки препарата и перевода кальция в раствор.
Осадок растворим в сильных кислотах, но нерастворим в уксусной кислоте:
2ВаC2O4+ 2СН3COOН = Ва(НC2O4)2+ Ва(СН3COO)2
Предел обнаружения кальция — 20 мкг. Мешают ионы Ва2+ и Sr2+, дающие с (NH4)2C2O4 аналогичные осадки. Отличительной особенностью осадков ВаС2О4 и SrC2O4 является их растворимость в уксусной кислоте:
Выполнение реакции: поместите в пробирку 1-2 капли раствора соли кальция, 3-4 капли раствора (NH4)2C2O4 и 1-2 капли 2 М раствора аммиака. Полученный осадок разделите на две части. В первую пробирку с осадком добавьте 2-3 мл 2 М раствора HCl, а в другую - 2-3 мл 2 М раствора СН3СООН.
Запишите наблюдения и уравнение реакции в молекулярном и ионно-молекулярном виде.
5.2. Окрашивание пламени - фармакопейная реакция. Второй метод открытия кальция основан на реакции окрашивания пламени. С помощью реакции окрашивания пламени можно открыть кальций во всех соединениях, как растворимых в воде, так и нерастворимых. Обязательным условием проведения этой пробы является смачивание препарата раствором хлористоводородной кислоты. Смысл этой операции заключается в том, чтобы перевести ту или иную соль кальция в хлорид кальция, который летуч и поэтому окрашивает бесцветное пламя в характерный кирпично-красный цвет.
Выполнение реакции: чистую нихромовую проволоку опустите в насыщенный раствор хлорида кальция или в сухую соль и затем внесите её в пламя газовой горелки. Запишите наблюдения в тетрадь.
5.3. Реакция с серной кислотой (предложена в ГФX). Серная кислота и растворимые сульфаты в концентрированных растворах образуют с катионом кальция Са2+ кристаллы гипса CaSO4× 2Н2О белого цвета, имеющие игольчатую форму:
Сa2+ + SO42- + 2 Н2О ® СaSO4 • 2Н2О¯
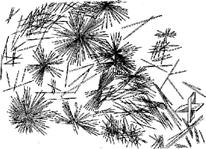
Эта микрокристаллоскопическая реакция основана на образовании характерных игольчатых кристаллов сульфата кальция CaSO4•2H2O (рис. 1, 2).
| 
|
| Рисунок 1. Кристаллы CaS04•2H2O, образующиеся в концентрированных растворах | Рис. 2. Кристаллы СаSО4•2Н2О, образующиеся в разбавленныхрастворах |
Предел обнаружения кальция – 1 мкг. Мешают ионы Рb2+, Ва2+ и Sr2+, если они присутствуют в 10-кратном избытке по отношению к кальцию.
Выполнение реакции: поместите на предметное стекло 1 каплю раствора соли кальция, прибавьте к нему 1 каплю 1 М раствора H2SO4 и 1 каплю С2Н5ОН для уменьшения растворимости. Осторожно нагрейте предметное стекло на водяной бане до появления белых кристаллов гипса.
Запишите наблюдения и уравнение реакции в молекулярном и ионно-молекулярном виде.
5.4. Гексацианоферрат (II) калия при рН> 7 в присутствии NH4Cl взаимодействует с ионами кальция с образованием белого кристаллического осадка состава Kn(NH4)mCaFe(CN)6 ¯, где n и m в зависимости от условий могут меняться от 0 до 2:
СаСl2+ K4Fe(CN)6+ NH4Cl = KNH4CaFe(CN)6¯ + 3КСl.
 Предел обнаружения кальция — 50 мкг. Осадок нерастворим в уксусной кислоте. Это позволяет отличить его от SrCO3, который может образоваться в присутствии ионов CO32–, содержащихся в щелочных растворах. Ионы Ва2+ и Mg2+ мешают реакции обнаружения кальция.
Предел обнаружения кальция — 50 мкг. Осадок нерастворим в уксусной кислоте. Это позволяет отличить его от SrCO3, который может образоваться в присутствии ионов CO32–, содержащихся в щелочных растворах. Ионы Ва2+ и Mg2+ мешают реакции обнаружения кальция.
Выполнение реакции. На часовом стекле перемешивают каплю исследуемого раствора с 2—3 каплями раствора реагента, затем добавляют 1–2 капли раствора NH4Cl, каплю этанола и снова перемешивают. Помутнение или появление кристаллического осадка указывает на присутствие кальция. Удобнее пользоваться черной капельной пластинкой или часовое стекло помещать на черную бумагу.
6. Открытие ионов магния
6.1. Реакция с гидрофосфатом натрия, Na2HPO4 . В основе метода открытия магния лежит реакция образования кристаллического магний-аммоний фосфата:
Mg2++ PO43–+ NH4+ → MgNH4PO4↓
Характерным признаком, позволяющим идентифицировать магний, является именно кристаллический осадок белого цвета. Дело в том, что из имеющихся реактивов и иона магния при тех или иных нарушениях методики могут образоваться еще два белых, но аморфных, т.е. не характерных, осадка, а именно гидроксид магния и фосфат магния. С целью предотвращения образования этих аморфных осадков к реакционной смеси добавляют хлорид аммония. Как известно, гидроксид магния растворяется в растворе хлорида аммонияи, следовательно, в его присутствии образоваться не может.
Важным моментом этого метода является поддержание необходимого значения рН реакционной массы. Оптимальным является значение рН 8-9. В кислой среде осадок магний-аммоний фосфата не образуется, а в сильнощелочной среде при рН > 10 вместо MgNH4PO4выпадает малохарактерный осадок фосфата магния (Mg3(PO4)2). В связи с этим, из трёх фосфорнокислых солей NaH2PO4, Na2HPO4и Na3PO4), каждую из которых можно использовать для этой реакции, более надежно использовать гидрофосфат натрия, поскольку при его применении сильнощелочная среда не получится даже в том случае, если аммиака добавлено больше, чем необходимо, возможность чего имеется при использовании фосфата натрия в соответствии с методикой ГФXI.
Реакция образования магний-аммоний фосфата является характерной кристаллоскопической пробой на магний, в связи с чем используется не только в фармакопейном, но и в токсикологическом анализе.
Выполнение реакции: поместите в пробирку 2-3 капли раствора соли магния, добавьте 2-3 капли раствора HCl (2 М) и 2-3 капли раствора Na2HPO4. Затем добавьте в пробирку 1 каплю раствора фенолфталеина и по каплям раствор аммиака (2 М), перемешивая содержимое пробирки стеклянной палочкой, до появления розовой окраски фенолфталеина (рН» 9). В присутствии иона Mg2+ выпадает белый кристаллический осадок.
Запишите наблюдения и уравнения реакций в молекулярном и ионно-молекулярном виде.
6.2 Реакция с 8-оксихинолином, (C9H6NOH). Ионы Mg2+ в аммиачной среде (рН = 9-10) с 8-оксихинолином образуют зеленовато-желтый осадок оксихинолята магния Mg(C9H6NO)2:
Mg2+ + 2 C9H6NOH → Mg(C9H6NO)2 + 2 H+
Выполнение реакции: поместите в пробирку 2-3 капли раствора соли магния, 3-4 капли аммиачного буферного раствора и 3-4 капли раствора 8-оксихинолина. Перемешайте смесь палочкой.
Запишите наблюдения и уравнение реакции в молекулярном и ионно-молекулярном виде.
6.3. Реакция с растворами щелочей. Ионы Mg2+ с раствором NaOH или KOH образуют белый аморфный осадок Mg(OH)2, нерастворимый в избытке щелочи, но растворимый в концентрированном растворе NH4Cl:
¯ Mg(OH)2 + 2 NH4+ → Mg2+ + 2 NH3 + 2 H2O
Выполнение реакции: поместите в пробирку 4-5 капель раствора соли магния и прибавьте к нему 4-5 капель раствора NaOH (2 М), а затем 5-7 капель раствора NH4Cl.
Запишите наблюдения и уравнения реакций в молекулярном и ионно-молекулярном виде.
7. Открытие ионов стронция
7.1. Гипсовая вода (насыщенный водный раствор CaSO4•2H2O) образует с ионами стронция белый кристаллический осадок:
SrCl2 + CaSO4 = SrSO4 ¯ + CaCl2
Выполнение реакции. К нескольким каплям раствора, содержащего ионы стронция, добавляют равный объем гипсовой воды и, потирая стеклянной палочкой по стенкам пробирки, нагревают в водяной бане 10 мин. Образуется муть.
7.2. Окрашивание пламени. Летучие соли стронция SrCl2, Sr(NO3)2  окрашивают пламя газовой горелки в карминово-красный цвет.
окрашивают пламя газовой горелки в карминово-красный цвет.
|
|