
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Факторы, влияющие на степень гидролиза.
|
|
Для солей, образованных обоими слабыми компонентами, степень гидролиза не зависит от концентрации раствора, а определяется только силой соответствующих основания и кислоты.
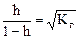 .
.
Поэтому разбавление раствора, в этом случае, не влияет на степень гидролиза.
Степень гидролиза солей, образованных слабым основанием или слабой кислотой зависит от концентрации соли C (аналогично закону разбавления Оствальда):
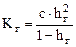

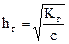 .
.
При разбавлении раствора степень гидролиза возрастает.
В этих случаях при разбавлении растворов возможно протекание гидролиза по второй и остальным ступеням. Например, для хлорида железа (III) при умеренном разбавлении происходит процесс:

При сильном разбавлении:
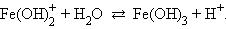
Степень гидролиза можно увеличить или уменьшить добавлением кислоты или щелочи, а также солей, имеющих в растворах кислую или щелочную реакцию среды.
Реакции нейтрализации являются экзотермическими процессами
H++ OH- = H2O DH= -56 кДж, следовательно, гидролиз солей эндотермичен. На основании принципа Ле Шателье легко объяснить усиление гидролиза при повышении температуры. В горячих растворах гидролиз может настолько усилиться, что произойдет полное разложение соли. Например, при кипячении раствора хлорида железа FeCl3 можно довести гидролиз до конца, до выпадения осадка Fe(OH)3.
Контрольные вопросы
1. Какие процессы относятся к реакциям гидролиза?
2. Какие из указанных солей подвергаются гидролизу, и какая форма гидролиза (простой, ступенчатый, полный) имеет место в каждом конкретном случае:
| а)K2CO3, | б) Na2S, | в) FeCl3, | г) NH4NO2, | д) Al2S3, | е) KCl? |
Напишите ионные и молекулярные уравнения соответствующих реакций. Определите реакцию среды.
3. Какую реакцию среды имеют растворы следующих солей:
| а) NaNO3, | б) NH4СNS, | в) NaCN, | г) CuSO4, | д) NH4NO3? |
Объясните причину и напишите ионные и молекулярные уравнения соответствующих реакций. Укажите случай и форму гидролиза.
4. Какую реакцию среды имеет раствор сульфата хрома? В каком направлении сместится равновесие при прибавлении: а) кислоты, б) щелочи, в) сульфата натрия, г) карбоната натрия, д) хлорида цинка? Увеличится или уменьшится при этом степень гидролиза?
5. Объясните понятия константы и степени гидролиза. Какие факторы влияют на степень гидролиза?
6. При сливании водных растворов AlCl3 и Na2S образуется осадок гидроксида алюминия и выделяется газ. Написать молекулярное и ионно-молекулярное уравнения соответствующего процесса.
7. Напишите уравнения реакций гидролиза следующих соединений:
8. а) AsCl5, б) AsCl3, в) SbCl3, г) BiCl3, д) AlN, е) GaP, ж) GeCl4, з) Al4C3, и) SiC, к) ZnCl2.
|
|