
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
IV. Катализ
|
|
IV.1. Основные понятия и определения
Катализ – изменение скорости реакции (положительный катализ – увеличение скорости реакции, отрицательный – уменьшение) под действием определенных веществ – катализаторов. Частным случаем положительного катализа является автокатализ, при котором свойствами катализатора обладает один или несколько продуктов реакции. Различают гомогенный и гетерогенный катализ. При гомогенном катализе все реагирующие вещества и катализатор находятся в одной фазе, при гетерогенном — катализатор составляет отдельную, обычно твердую, фазу.
Явление катализа имеет огромное значение как в природе, так и в химической промышленности. Многие природные процессы протекают под воздействием природных биологических катализаторов - ферментов, зачастую во много раз превосходящих по активности синтетические неорганические катализаторы. Каталитические процессы широко используют в промышленности: производство азотной и серной кислот, аммиака, получение синтетического каучука, лекарственных веществ и т. д. невозможны без катализаторов.
Основные положения катализа:
1). Катализаторы расходуются на промежуточных этапах реакции и полностью выделяются по завершении реакции в химически неизменном виде (может изменяться физическое состояние - явления спекания, разрыхления катализаторов и т. д.). Участие катализатора не отражается на стехиометрии реакции. Следовательно, он не может вызвать протекания реакций, для которых в данных условиях dG> 0, а может лишь увеличить скорость реакции в том случае, если dG< 0.
Пример: Окисление тиосульфат-иона перекисью водорода катализируется молибденовой кислотой:
S2 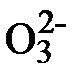 + 4H2O2
+ 4H2O2  2S
2S 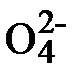 + 2H+ + 3H2O
+ 2H+ + 3H2O
Предполагается, что промежуточным продуктом является пермолибдат-ион и реакция протекает по схеме:
1) 4Mo 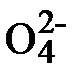 + 4H2O2 ® 4Mo
+ 4H2O2 ® 4Mo 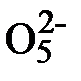 + 4H2O
+ 4H2O
2) S2 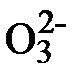 + 4Mo
+ 4Mo 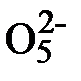 + H2O ® 2S
+ H2O ® 2S 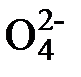 + 2H+ + 4Mo
+ 2H+ + 4Mo 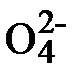
2). Катализатор в обратимой реакции не смещает равновесия, а в равной степени ускоряет и прямую, и обратную реакцию. В присутствии катализатора состояние равновесия достигается намного быстрее, однако он не влияет на величину константы равновесия реакции и не может увеличить выход продуктов реакции при заданных условиях.
3). Селективность (избирательность) катализатора – способность ускорять одну из возможных при данных условиях параллельных реакций. Если в данных условиях термодинамически возможно протекание нескольких параллельных реакций, то катализатор вследствие свойства селективности ускоряет одну из этих реакций. Положение равновесия для нее достигается значительно быстрее, чем для других реакций, поэтому основными продуктами будут вещества, образующиеся в этой реакции, а продукты других реакций будут присутствовать в качестве примесей к основным.
Селективность катализатора может быть охарактеризована долей реагента, превратившегося в целевой продукт (интегральная селективность), или отношением скорости образования целевого продукта к сумме скоростей химического превращения реагентов по всем возможным направлениям (дифференциальная селективность). Наибольшей селективностью (95-100%) обладают ферменты и некоторые гомогенные катализаторы.
4). Специфичность катализатора заключается в его способности ускорять только одну реакцию или группу однотипных реакций и не влиять на скорость других реакций. Так, например, многие переходные металлы (платина, медь, никель, железо и т.д.) являются катализаторами для процессов гидрирования; оксид алюминия катализирует реакции гидратации и т.д.
Специфичность каталитического действия того или иного катализатора определяется химическим составом, строением и структурой катализатора и обусловлена специфичностью химических связей, которые возникают между катализатором и реагентом. В образовании химической связи с реагентами участвуют лишь определенные группы атомов катализатора. Такую группу атомов принято называть каталитическим или активным, центром. В гомогенном катализе каждая молекула катализатора может рассматриваться как активный центр. В комплексных соединениях переходных металлов в качестве активных центров может выступать " вакантное место" в координационной сфере комплексного соединения иона металла. Активные центры гетерогенных катализаторов находятся на поверхности твердого тела и представляют собой один или группу атомов, ионов кристаллической решетки. Наибольшей специфичностью обладают природные катализаторы - ферменты.
5). Любая каталитическая реакция включает по крайней мере две стадии:
· взаимодействие активного центра с молекулой реагента и образование промежуточного соединения;
· распад промежуточного соединения с образованием продуктов реакции и " свободного" активного центра.
Последний вновь вступает во взаимодействие с молекулами исходных веществ. Такие циклы могут повторяться многократно. Число циклов, совершающихся, за единицу времени на одном активном центре, называют числом оборотов катализатора. Мерой каталитической активности является число оборотов катализатора. Для гомогенных катализаторов число оборотов равно отношению скорости реакции к молярной концентрации катализатора. Число оборотов катализатора измеряется в с-1 и может варьировать в широких пределах: от 10-7 (для катализаторов кислотно-основного типа) до 105 (для ферментов).
Для гетерогенных катализаторов число оборотов, как правило, не удается определить, так как природа и число активных центров на поверхности катализатора обычно неизвестны. Поэтому их активность характеризуют скоростью реакции, отнесенной к единице поверхности катализатора.
6). Катализаторы могут быть чувствительны к наличию в системе некоторых веществ, не участвующих в реакции. Причем возможны два случая: в первом эти вещества увеличивают активность катализатора (тогда их называют промоторами), во втором - уменьшают или вообще прекращают его действие (ингибиторы, каталитические яды).
Явления промотирования и отравления объясняются способностью некоторых веществ вступать в химическое взаимодействие с активным центром катализатора. При этом может произойти формирование новой более активной структуры активного центра и повышение активности катализатора. Напротив, образование устойчивых инертных соединений активного центра с молекулой каталитического яда приводит к дезактивации и отравлению катализатора.
7). Первая причина увеличения скорости реакции при положительном катализе является уменьшение энергии активации при протекании реакции через активированный комплекс с участием катализатора. Это связано с тем, что энергии активации образования промежуточных комплексов катализатора с исходными реагентами и образования из них продуктов реакции обычно значительно ниже энергии активации некаталитической реакции.

На рис. представлено изменение энергии системы в каталитической и некаталитической (бимолекулярной) реакции А + В ® С.
Рис. Изменение потенциальной энергии в каталитической
и некаталитической реакциях.
В присутствии катализатора (К) эта бимолекулярная реакция протекает в две стадии с образованием промежуточного комплекса АК:
А + К ® АК,
АК + В ® С + К.
Обе стадии каталитической реакции требуют затраты энергии активации Е 1 и Е 2, однако каждая из этих энергий меньше энергии активации некаталитической реакции. Влияние понижения энергии активации на скорость реакции можно оценить по следующему уравнению (предэкспоненциальные множители в уравнении Аррениуса для обеих реакций одинаковы):
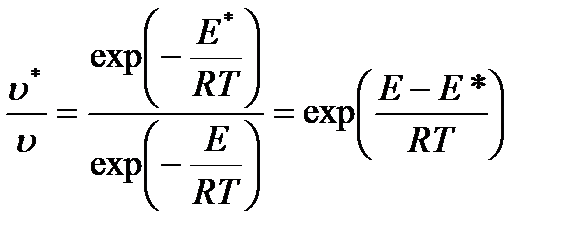 ,
,
где υ * и υ - скорости каталитической и некаталитической реакции, соответственно; Е * и Е - соответствующие энергии активации. Так как величина D E стоит в показателе степени, то даже небольшое снижение энергии активации приводит к значительному возрастанию скорости реакции. Например, для реакции разложения ацетальдегида
СН3СНО ® СН4 + СО,
протекающей при 800К в газовой фазе, энергия активации равна примерно 190 кДж/моль. Реакция катализируется парами йода, при этом энергия активации снижается до 135 кДж/моль, т.е. D E = 55 кДж/моль (» 28%). Применяя формулу получим:
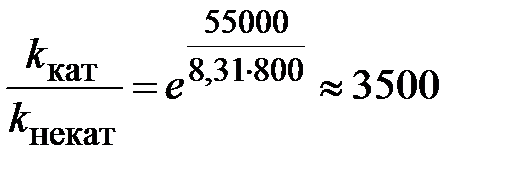 ,
,
т.е. в присутствии катализатора реакция идет в 3500 раз быстрее.
8). Вторая причина увеличения скорости каталитической реакции - увеличение предэкспоненциального множителя. Согласно теории активированного комплекса определяется величиной энтропии активации т.е. увеличение скорости реакции связано со значительным увеличением энтропии активации.
Величина энтропии активации несет важную информацию о механизме каталитической реакции и структуре активированного комплекса. Большие отрицательные значения энтропии активации характерны для реакций, протекающих через активированный комплекс, включающий одновременно молекулы обоих реагентов и активный центр катализатора. В таком активированном комплексе образование новых и разрыв связей в молекулах исходных веществ происходит одновременно или синхронно. Для таких реакций наблюдаются низкие значения энергии активации. В этом случае говорят о синхронном механизме реакции. Для реакций, в которых образованию активированного комплекса предшествует разрыв связей в молекулах исходного вещества, характерны положительные значения энтропии активации, а значит, и высокие значения энергии активации, хотя они и остаются более низкими по сравнению с некаталитическим процессом. Механизм таких реакций называют диссоциативным.
|
|