
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теория активных столкновений (ТАС)
|
|
Основные положения теории активных (молекулярных) столкновений:
1. Любая химическая реакция протекает через промежуточную стадию образования активных молекул реагирующих веществ (только из активных молекул могут образоваться продукты реакции). Активные молекулы всегда находятся в равновесии с неактивными (нормальными) молекулами.
2. Реакция образования активных молекул эндотермична и идет с поглощением теплоты E ΄ в расчете на 1 моль активных молекул. Схематично можно записать:
А норм. 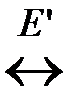 А *акт.
А *акт. 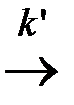 продукты
продукты
На первой стадии устанавливается равновесие меду активными и нормальными молекулами реагирующих веществ, на второй стадии из активных молекул образуются продукты реакции (константа скорости k ΄).
4. Константа скорости k ΄ не зависит от температуры, т. е. скорость реакции при повышении температуры увеличивается только за счет увеличения концентрации активных молекул.
5. Активные молекулы отличаются от неактивных только тем, что имеют некоторую избыточную энергию по сравнению со средней энергией молекул. Молекулы приобретают избыточную энергию путем соударения молекул и взаимного перераспределения энергии при этом.
Химическая реакция начинается со столкновения двух частиц. Однако, как показывают опыты, число прореагировавших частиц (молекул, ионов) при не очень высоких температурах на много порядков ниже числа сталкивающихся частиц. Так, например, в реакции:
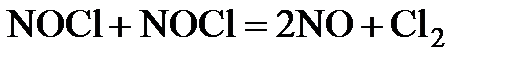
при 529 К и 1 атм образуется примерно 2·10-6 моль NO в 1 см3 за 1 с. Расчет полного числа столкновений при этих условиях приводит к значениям порядка 105 молей NO/(см3·с). Если обозначить через z число общих столкновений, а символом za – число активных столкновений, приводящих к реакции, то для указанной реакции
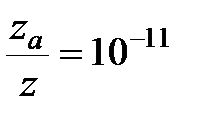 ,
,
т. е. активным столкновением будет только одно из 1011 общих столкновений.
Именно расхождения между значениями z и za привели Аррениуса к идее о том, что в реакцию могут вступать только молекулы, обладающие определенным избытком энергии (энергией активации). Теория активных столкновений приводит к следующему соотношению между za и z:

в котором учтена зависимость z от температуры Т (z = аT 1/2 n 2). Величина n- число молекул в см3; Ea – так называемая “ классическая” энергия активации, равная разности между потенциальными энергиями активных и исходных молекул; а – константа, зависящая от размеров вступающих в реакцию молекул.
Выражение для константы скорости:
 .
.
Теория активных соударений позволила наметить путь теоретического расчета константы скорости реакции: предсказала правильный ход зависимости константы скорости от температуры, позволила рассчитать для ряда реакций константы скорости по известному значению энергии активации. Представления об энергетическом барьере и об «активных» молекулах хорошо объясняют ряд фактов.
1. Химическая реакция всегда протекает с несоизмеримо меньшей скоростью, чем это соответствует расчету с предположением результативности каждого соударения.
2. Для сходных реакций при одинаковых температурах и концентрациях число соударений приблизительно одинаково, а скорость может отличаться в десятки тысяч раз.
3. Число соударений с изменением температуры на 10 град изменяется на 2-3%, однако скорость реакции изменяется в 2-4 раза.
Недостатки:
· Не может быть объяснена резкая температурная зависимость скорости реакции, вследствии того, что величина Z слабо изменяется с изменением температуры  .
.
· Не позволяет рассчитывать значение энергии активации исходя из параметров молекул реагирующих веществ.
|
|