
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Константа равновесия. Все химические реакции можно разделить на две группы: необратимые и обратимые реакции
|
|
Все химические реакции можно разделить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца - до полного израсходования одного из реагирующих веществ. Например, разложение нитрата аммония
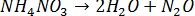
Обратимая реакция может протекать как в прямом, так и в обратном направлении. Примером обратимой реакции может служить синтез йодоводорода:

Вначале, при смешении исходных веществ, скорость прямой реакции велика, а обратной - равна нулю. Согласно закону действия масс выражение для скорости прямой реакции запишется следующим образом:

Исходные вещества в процессе реакции будут расходоваться, следовательно, скорость прямой реакции будет уменьшаться. Одновременно появятся продукты реакции, их концентрация будет возрастать. Начнет идти обратная реакция, скорость которой будет увеличиваться:

Когда скорости прямой и обратной реакций станут одинаковыми, наступит химическое равновесие.
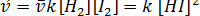
или

Отношение констант скорости прямой и обратной реакций тоже представляет собой константу. Она называется константой равновесия данной реакции – K, 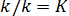 . Отсюда окончательно:
. Отсюда окончательно:  . Концентрации, приведенные в левой части этого уравнения, называются равновесными концентрациями. Константа равновесия при постоянной температуре представляет собой постоянную величину.
. Концентрации, приведенные в левой части этого уравнения, называются равновесными концентрациями. Константа равновесия при постоянной температуре представляет собой постоянную величину.
Если записать обратимую реакцию в общем виде:

то константа равновесия выразится уравнением
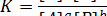
Если все компоненты реакции находятся в газообразном состоянии, то выражение константы равновесия можно записать через парциальные давления:
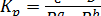
Уравнение константы равновесия показывает, что в данных условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Изменение концентрации любого из этих веществ влечет за собой изменения концентрации всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Разобранные примеры являются примерами гомогенного равновесия. В качестве примера гетерогенного равновесия рассмотрим реакцию разложения известняка

Простейшее выражение для константы равновесия этой реакции
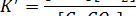
До тех пор пока твердые известняк и негашеная известь находятся в контакте с газом, их влияние на равновесие не изменяется. Следовательно, члены  и
и 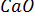 в выражении для константы равновесия остаются постоянными и могут быть включены в К. При этом получается новое выражение:
в выражении для константы равновесия остаются постоянными и могут быть включены в К. При этом получается новое выражение:
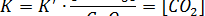
Рассмотрим еще один пример – испарение воды:

Этот процесс может нормально рассматриваться как химическая реакция. Запишем выражение константы равновесия:

Поскольку 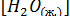 - постоянная величина (до тех пор, пока в наличии имеется жидкая вода), можно включить ее в константу равновесия. Таким образом, получается выражение
- постоянная величина (до тех пор, пока в наличии имеется жидкая вода), можно включить ее в константу равновесия. Таким образом, получается выражение  .
.
С практической точки зрения все сказанное выше означает, что концентрации чистых жидкостей и твердых веществ просто исключаются из выражений для констант равновесия. (Однако они входят в нее неявным образом).
|
|