
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Классификация химических реакций
|
|
Химическая кинетика. Катализ
Из химической термодинамики известно, что критерием реакционной способности веществ при постоянных давлении и температуре является убыль свободной энергии Гиббса. Если Δ G < 0, то реакция может идти самопроизвольно в направлении состояния равновесия; если Δ G > 0, самопроизвольное протекание реакции невозможно. Таким образом, термодинамика позволяет ответить на вопросы: 1) возможна ли химическая реакция в данных условиях? 2) при каких условиях наступает равновесие? 3) как полно эта реакция осуществляется?
Но химика интересует и вопрос о том, как быстро можно достичь состояния равновесия, т.е. какова скорость химической реакции? В этом случае появляется новый фактор - время, отсутствующий в термодинамике.
Раздел физической химии, посвященный изучению скорости химических реакций и механизму их протекания в зависимости от внешних условий, называют кинетикой (от греч " кинетикос" - относящийся к движению).
Все химические реакции классифицируют по следующим признакам: степень сложности (механизм), природа частиц, число фаз или молекул, участвующих в реакции.
Классификация химических реакций
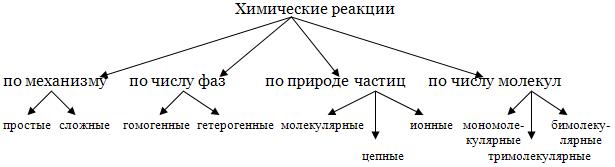
По механизму химические реакции делят на простые и сложные. К простым относятся реакции, которые протекают только в одну стадию. Например, разложение галогенов: I2 = 2I. Если же реакция протекает в несколько стадий, то она является сложной. Например, реакция разложения пероксида водорода записывается суммарным уравнением:
2Н2О2 = 2Н2О + О2
Однако эта реакция протекает в две стадии и является сложной:
1) Н2О2 = Н2О + О
2) О + О = О2.
Сложные реакции в свою очередь делят на последовательные, параллельные и сопряженные. Последовательные - реакции с промежуточными стадиями типа А → В → С. Параллельные - исходные вещества реагируют сразу в нескольких направлениях: 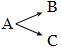
Например, 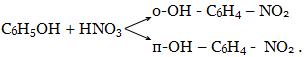
Сопряженные - реакции, из которых одна протекает лишь совместно с другой. Например, Н2О2 легко окисляет соединения железа, но практически не окисляет бензол. Однако если провести эти реакции в общей смеси, то Н2О2 в этом случае окисляет и бензол:
Fe2+ + H2O2 = Fe3+ + OH-
OH- + OH- + C6H6 = C6H5OH + H2O.
По числу фаз химические реакции делят на гомогенные - протекают в одной фазе и гетерогенные - протекают на границе раздела фаз.
По природе частиц реакции делят на молекулярные (реагируют молекулы), ионные (реакции между ионами) и цепные. В последнем случае участвуют атомы и радикалы.
В основе классификации по числу частиц лежит молекулярность реакции - это минимальное число молекул, принимающих участие в акте химического взаимодействия. Выделяют мономолекулярные, бимолекулярные и тримолекулярные.
Для того, чтобы молекулы прореагировали, они должны сблизиться на расстояние порядка атомных размеров, когда электроны атомов одной молекулы попадут в сферу действия электронов атомов другой молекулы. Такое сближение молекул называют столкновением. Но не при любом столкновении молекулы взаимодействуют. Столкновения, при которых молекулы реагируют, называют элементарными актами.
Скоростью химической реакции называют количество элементарных актов реакции, совершающихся в единицу времени.
Для удобства расчетов скорость химической реакции определяют по изменению концентрации реагирующих веществ за единицу времени. Для определения скорости реакции достаточно знать изменение концентрации во времени только одного из участвующих в реакции веществ, причем безразлично какого вещества - исходного или конечного. Различают среднюю и истинную скорость реакции. Средней скоростью реакции называют отношение изменения концентрации вещества (уменьшения концентрации исходного вещества или увеличение концентрации продукта реакции) к промежутку времени, в течение которого это изменение произошло:
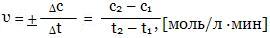
Скорость реакции всегда считается величиной положительной, но отношение Δ c/Δ t может быть отрицательным, если υ изучается по изменению концентрации исходных веществ.
Чем ближе сдвигаются между собой t1 и t2, тем меньше становится Δ t и Δ c. Тогда отношение Δ c/Δ t все больше приближается к значению истинной скорости. Предельная величина Δ c/Δ t, когда Δ t стремится к нулю как к своему пределу (Δ t → 0), называется истинной скоростью химической реакции:
υ = lim (± Δ c/Δ t) = ± dc/dt,
где dc/dt - производная от концентрации по времени. Истинную скорость еще называют мгновенной скоростью реакции, т.е. скорость в данный момент времени.
Основным постулатом химической кинетики является закон действующих масс, выражающий зависимость скорости реакции от концентраций реагирующих веществ: при постоянной температуре скорость химической реакции в данный момент пропорциональна произведению молярных концентраций реагирующих веществ. Для простой тримолекулярной реакции
2NO + O2 = 2NO2
υ = k · [NO]2 [O2],
где k - константа скорости реакции.
Таким образом, в математическом выражении закона действующих масс для всех простых гомогенных реакций каждая из концентраций реагирующих веществ входит в степени, равной коэффициенту перед формулой данного вещества в уравнении реакции.
Эти степени называют частными порядками по веществу, а сумма их называется полным порядком. Эта реакция имеет первый порядок по О2 и второй порядок по NO. Полный ее порядок будет равен 3. Кинетический порядок может иметь значения от 0 до 3, включая дробные числа.
Теперь рассмотрим сложную реакцию:
2С2Н6 + 7О2 = 4СО2 + 6Н2О.
Для этой реакции по закону действующих масс
υ = k · [С2Н6]2 [O2]7.
Получается, что порядок реакции равен 9. Но это не соответствует действительности, потому что это уравнение суммарное, т.е. показывает начальный и конечный этап реакции. Таким образом, порядок реакции совпадает с ее молекулярностью только в случае простых реакций. А для сложных реакций частные порядки по веществам, участвующим в реакции и дающие в сумме полный порядок, находятся экспериментальным путем. В общем случае для сложной реакции
аА + вВ = сС + дД
υ = k · [А]m [В]n.
m + n - общий порядок реакции. m и n в большинстве случаев не равны стехиометрическим коэффициентам.
Объясняется это тем, что сложные реакции идут через ряд последовательных мономолекулярных и бимолекулярных промежуточных стадий с разными скоростями. Общая скорость сложной реакции и ее кинетическое уравнение будут определяться самой медленной стадией, которая называется лимитирующей.
Молекулярность простой реакции, а лимитирующая стадия и будет простой реакцией, не может быть больше 3, так как по кинетической теории вероятность столкновения 4 и более молекул определенного вида ничтожно мала. Поэтому и порядок реакции не может быть больше 3.
Порядок реакции определяет характер зависимости скорости реакции от концентрации реагирующих веществ. И зная порядок реакции, можно сделать некоторые предположения о механизме ее протекания.
К реакциям 1 порядка относится ряд мономолекулярных реакций распада и изомеризации сложных молекул в газах и растворах, разложение эфиров, реакции радиоактивного распада атомных ядер, многие бимолекулярные реакции при условии, что концентрация одного из реагирующих веществ поддерживается постоянной (например, реакции гидролиза при большом избытке воды).
Все реакции 1 порядка подчиняются кинетическому уравнению для мономолекулярных реакций - независимо от того, какую молекулярность они имеют:
υ = k · [А].
Если начальная концентрация вещества А равна а моль/л, а за время t прореагировало этого вещества х моль/л, то в данный момент времени концентрация вещества А стала а - х моль/л.
После дифференцирования и интегрирования этого уравнения
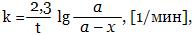
т.к. величина под знаком lg размерности не имеет.
К реакциям II порядка относятся многие бимолекулярные и тримолекулярные реакции. Кинетическое уравнение для них имеет вид
υ = k · [А] · [В].
Если начальная концентрация вещества А равна а моль/л, вещества В - в моль/л, а х - убыль концентраций А и В за время t, то
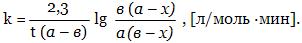
Реакции нулевого порядка встречаются главным образом среди гетерогенных реакций, у которых скорость стадий зависит от диффузии фаз. Примером может служить разложение иодоводорода на поверхности золота или разложение аммиака на поверхности вольфрама или молибдена.
υ = k · [А]0 = k, т.к. [А]0 = 1, υ = const.
Дробный порядок возможен в том случае, если механизм реакции имеет многостадийный характер, причем самых медленных стадий окажется несколько, или лимитирующая стадия окажется обратимой. Пример - реакция превращения о-водорода в п-водород (в молекуле ортоводорода спины ядер атомов параллельны, а в молекуле параводорода - антипараллельны):
о-Н2 + Н = п-Н2 + Н.
Итак, разница между порядком химической реакции и ее молекулярностью состоит в том, что порядок относится к кинетическому уравнению, описывающему скорость реакции, а молекулярность - к ее механизму и показывает, сколько молекул участвует в элементарном акте взаимодействия.
Определение порядка реакции очень важно для изучения ее механизма. Из многих методов опреления порядка реакции наиболее распространены:
1) метод изолирования (метод Оствальда) - сначала определяют частные порядки реакции по каждому веществу, затем - общий порядок суммированием частных порядков;
2) метод подбора уравнений - экспериментальные данные по изменению концентрации реагирующего вещества в ходе опыта через определенные промежутки времени подставляют в уравнения константы скорости реакции разных порядков. Порядок реакции по данному веществу будет соответствовать тому кинетическому уравнению, которое даст при заданной температуре постоянное значение величины константы скорости реакции в различные моменты времени.
Скорость химической реакции зависит от многих внутренних и внешних факторов. К внутренним факторам относят природу и агрегатное состояние реагирующих веществ. Внешние факторы составляют условия протекания реакции: концентрация реагентов, температура, катализаторы, среда, примеси и многие другие.
Влияние природы реагирующих веществ является одним из решающих факторов. Например, взаимодействие водорода с фтором при комнатной температуре происходит со взрывом, а водород с хлором в этих же условиях практически не взаимодействуют. Взаимодействие между ионами в водных растворах протекает быстро. Если в молекулах вещества связи ковалентные, то они реагируют медленно, если эти связи неполярны.
Влияние агрегатного состояния реагирующих веществ. Известно, что взаимодействие веществ в парообразной и газообразной фазах протекает быстрее, чем в жидком или твердом состоянии. В этом случае на скорость реакции оказывает влияние скорость диффузии реагирующих веществ. Для увеличения скорости диффузии реагирующих жидких веществ применяют перемешивание. С целью увеличения скорости реакции между твердыми веществами их измельчают.
Из внешних факторов особое влияние оказывают концентрации реагирующих веществ, температура и катализаторы.
Зависимость скорости реакции от концентрации реагирующих веществ показывает закон действующих масс (см. выше).
Влияние температуры на скорость химической реакции.
В 1884 г. Я.Г. Вант-Гофф эмпирически установил правило, согласно которому при повышении температуры на каждые 10°С скорость химической реакции увеличивается в 2-4 раза. Это правило может быть использовано для приблизительной характеристики влияния температуры на скорость химической реакции в небольшом интервале температур.
При повышении температуры концентрации реагирующих веществ меняются сравнительно мало. Поэтому в кинетическом уравнении
υ = k · [А] · [В].
влияние температуры будет практически сказываться только на изменении К. Это влияние характеризуется температурным коэффициентом скорости реакции γ, который равен отношению константы скорости реакции при температуре t + 10 к константе скорости при температуре t:
γ = kt+10 / kt
Через скорость:
υ 2/υ 1 = γ (t2 - t1) / 10
Например, известно, что при нагревании газа с 30° до 60° С скорость реакции увеличилась в 8 раз. Следовательно, согласно правилу Вант-Гоффа
8 = γ (60 - 30) /10 = γ 3;
γ = 2.
Но кинетическая теория не в состоянии объяснить причину быстрого роста скорости химической реакции с повышением температуры, так как не каждое соударение молекул приводит к взаимодействию. В связи с этим кинетические представления были пополнены теорией активации.
Энергия активации (Е, [Дж/моль]) - это минимальная энергия, которой должны обладать реагирующие частицы, чтобы столкновения между ними приводили к химическому взаимодействию. Зависимость k скорости реакции и Е отражает уравнение Аррениуса:
lg k = lgA - E/2, 3 · R · T,
где А - константа Аррениуса, характеризующая конкретную реакцию. Находится графическим методом зависимости lg k= f (1/T). tg угла наклона к оси абсцисс дает величину Е/2, 3 · R · T.
Явление, при котором происходит изменение скорости химической реакции под действием катализаторов, называется катализом. Катализатор (Kt) - вещество, которое изменяет скорость химической реакции, а само остается в неизменном виде по окончании реакции.
Катализаторы отличаются избирательностью (селективностью) действия, т.е. способностью изменять скорость только одной или группы вполне определенных реакций.
В случае обратимой реакции положение химического равновесия катализатор не смещает, т.к. он в равной степени ускоряет (или замедляет) как прямую, так и обратную реакции и лишь изменяет время достижения химического равновесия.
Замечено, что примеси по-разному влияют на катализаторы. Вещества, которые сами по себе не обладают каталитической активностью, но, будучи добавленными к катализатору, значительно повышают его действие, называют промоторами или активаторами. Например, если к оксиду ванадия добавить небольшое количество сульфатов щелочных металлов, его каталитическая активность повышается в сотни раз при окислении SO2 в SO3.
Существуют также каталитические яды - вещества, которые воздействуя на катализаторы, отравляют их, т.е. снижают их активность. Кислотные катализаторы отравляются примесями оснований, и наоборот.
Все каталитические реакции принято разделять на реакции гомогенного и гетерогенного катализа. Гомогенным называют катализ, если катализатор и реагирующие вещества находятся в одной фазе, гетерогенным - если в разных.
Теорию гомогенного катализа можно сформулировать в виде следующих основных положений:
1) катализ осуществляется путем образования неустойчивого активированного комплекса (промежуточного соединения) реагирующего вещества и катализатора;
2) образование промежуточного соединения является обратимым и относительно быстрым процессом;
3) разложение промежуточного соединения с образованием продуктов реакции и восстановлением катализатора происходит относительно медленно, поэтому общая скорость процесса пропорциональна концентрации промежуточного соединения.
Например, А + В → С.
Без Kt: А + В → АВ* → С
С Kt: А + Kt → АKt
Аkt + В → (АВ*)Kt
(АВ*)Kt → С + Kt
Весь процесс гетерогенного катализа можно разделить на три стадии:
1) диффузия реагирующих веществ к поверхности катализатора;
2) адсорбция реагирующих веществ и реакция на поверхности катализатора;
3) десорбция продуктов реакции с освобождением поверхности катализатора.
При гетерогенном катализе реакция происходит на поверхности катализатора. Поэтому необходимым этапом такого катализа является адсорбция реагирующих веществ на катализаторе. Однако поверхность катализатора неоднородна и состоит из совокупности адсорбционных центров различной активности. Адсорбционные центры, на которых протекают реакции образования промежуточных соединений, являются каталитически активными. В гетерогенном катализе их называют активными центрами. Адсорбированные молекулы связываются с активными центрами катализатора, образуя промежуточные соединения. В свою очередь, поверхностные промежуточные соединения вступают во взаимодействие между собой или с молекулами, диффундирующими из другой фазы. При этом образуются продукты реакции, и регенерируется катализатор.
Существует несколько теорий гетерогенного катализа. Одна из них - мультиплетная теория А.А. Баландина - была предложена в 1929 г. Основу этой теории составляют два принципа:
1) принцип геометрического или структурного соответствия;
2) принцип энергетического соответствия.
По первому принципу для различных реакций число адсорбционных участков, составляющих активный центр, бывает равным 2, 3, 4, 6 и т.д. Такие активные центры называют дублетами, триплетами, квадруплетами, секстетами, а в общем случае - мультиплетами. В зависимости от расстояний, геометрического расположения и вида атомов или ионов, составляющих мультиплет, в адсорбируемых молекулах будут ослабляться и перераспределяться различные связи. В этом и проявляется избирательное действие катализатора.
Суть второго принципа заключается в том, что должно быть соответствие между энергией связи между атомами в реагирующих молекулах и энергией связей, которые образуются в мультиплетном комплексе между участвующими в реакции атомами и катализатором. Если связи очень слабые, мультиплетный комплекс не образуется. Если очень сильные - не произойдет его распад.
Теория позволяет вычислить значения энергии этих связей и тем самым предсказать условия для подбора катализаторов.
Накопление новых опытных данных показало, что в мультиплетной теории содержится определенное рациональное звено. Однако значение геометрического принципа, по-видимому, преувеличено. Принцип энергетического соответствия сохраняет свое значение и в настоящее время.
В последнее время развивается квантово-химическая теория катализа, в которой к системе адсорбат - катализатор применяются приближенные квантово-химические методы расчета. В связи со сложностью проблемы полученные результаты еще очень невелики, но в принципе это направление перспективно и в будущем оно позволит предсказывать каталитическую активность. Однако трудность расчета и сложность системы катализатор - реагенты не позволяют использовать квантово-химическую теорию для выбора оптимального катализатора.
|
|