
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задача 6. При некоторой температуре константа равновесия реакции H2(г) + I2(г) ↔ 2HI(г) равна 50
|
|
При некоторой температуре константа равновесия реакции H2(г) + I2(г) ↔ 2HI(г) равна 50. Рассчитать равновесные концентрации веществ, если исходные концентрации водорода и йода были соответственно 0, 6 и 0, 8 моль/л.
Решение. Предположим, что к моменту равновесия прореагировало х молей водорода и, значит, х молей йода.
Тогда их равновесные концентрации будут 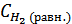 = 0, 6 - х моль/л,
= 0, 6 - х моль/л, 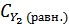 )= 0, 8 – х моль/л, а равновесная концентрация йодистого водорода составит
)= 0, 8 – х моль/л, а равновесная концентрация йодистого водорода составит 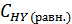 = 2х моль/л. Выражение константы равновесия для этой реакции будет КС =
= 2х моль/л. Выражение константы равновесия для этой реакции будет КС = 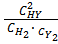 .
.
Подставляя в него соответствующие выражения, получим 50 = 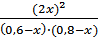 , откуда х 2 - 1, 52 х + 0, 52 = 0,
, откуда х 2 - 1, 52 х + 0, 52 = 0,
х 1, 2 = 0, 76 ± 0, 24, х 1 = 1, х 2 = 0, 52.
Первое значение не подходит по смыслу, так как уменьшение концентрации не может быть больше, чем содержание исходной концентрации водорода и йода. Поэтому искомое значение х составляет 0, 52моль/л. Следовательно, равновесные концентрации веществ будут равны: 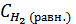 = 0, 6 - 0, 52 = 0, 08 моль/л,
= 0, 6 - 0, 52 = 0, 08 моль/л, 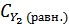 = 0, 8 - 0, 52 = 0, 28 моль/л,
= 0, 8 - 0, 52 = 0, 28 моль/л, 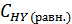 = 2∙ 0, 52 = 1, 04 моль/л.
= 2∙ 0, 52 = 1, 04 моль/л.
|
|