
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Влияние температуры на скорость реакций
|
|
Правило Вант-Гоффа: в области невысоких температур (0÷ 300) 0 С при увеличении температуры на 100 скорость реакции возрастает в 2 – 4 раз
γ = (2-4) - температурный коэффициент показывает, во сколько раз увеличивается скорость при повышении температуры на 100
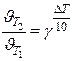 или
или 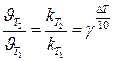 при С = const (для приблизительных расчётов)
при С = const (для приблизительных расчётов)
 gэкзотерм.< gэндотерм. J DrН> 0
gэкзотерм.< gэндотерм. J DrН> 0
DrН< 0
Т
Аррениус: К реакции приводит столкновение лишь активных молекул, энергия которых больше определённой величины энергии Ea, необходимой для ослабления и перестройки связей, т.е. для перехода веществ в состояние активированного комплекса
Активированный комплекс – переходное состояние системы (старые связи ослабли, новые не сформировались), для его образования необходима энергия Еа
Для реакции: АВ + ДС → АД + ВС

 А – В А….В А - Д
А – В А….В А - Д

 +
+
Д – С Д….С В - С
исходные активированный продукты
молекулы комплекс реакции

Для обратимой реакции АВ + ДС = АД + ВС (Еаэкз ˂ Еаэнд): ∆ rHпр = Hкон. – Hнач = Еапр - Еаобр Þ связь термодинамических и кинетических параметров
Величина Еа отражает влияние природы исходных частиц на скорость реакции (чем прочнее связи, тем труднее их разорвать, тем больше Еа и меньше скорость). Определяют на основании значений Есвязей.
Еа большинства реакций (40 ÷ 400) кДж/моль.
Доля активных частиц растет под действием:
тепловой, световой, электрической энергий, рентген. лучей и др.
При увеличении Т число активных частиц ↑ и скорость ↑
Уравнение С.Аррениуса 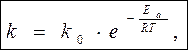
k – константа скорости реакции при Т
k 0 – предэкспоненциальный множитель, не зависит от Т
k 0 = k , если Е а = 0
Физич. смысл k 0 - частотно-ориентационный фактор, учитывающий влияние числа столкновений (z) и ориентации молекул (Poр.) на скорость k 0 = z P oр
Для осуществления реакции необходима благоприятная ориентация молекул в момент столкновения.
 |
|
|