
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задача 4. При изучении кинетики термического разложения ацетона, являющегося реакцией первого порядка, в соответствии с уравнением:
|
|
При изучении кинетики термического разложения ацетона, являющегося реакцией первого порядка, в соответствии с уравнением:
СН3СОСН3(г) ® С2Н4(г) + СО(г) + Н2(г)
получены следующие экспериментальные данные при Т = 802 К: давление
в реакторе изменилось от начального р 0 = 312 мм. рт. ст. до 408 мм. рт. ст.
за 390 с. Рассчитайте константу скорости реакции.
Решение. Все вещества в системе находятся в газообразном состоянии, и, учитывая условия проведения опыта, предполагаем, что они подчиняются законам идеальных газов. Следовательно, концентрация и парциальное давление газа связаны зависимостью p i =c i × R× T или
Отсюда, для реакции I-го порядка и
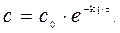
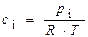 |
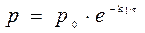
Если р0 – это начальное давление ацетона в реакционном сосуде, то для решения задачи необходимо определить парциальное давление этого вещества к моменту времени, когда общее давление составило 408 м рт.ст.
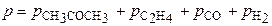 = 408
= 408
Из стехиометрии реакции видно, что 1 моль ацетона, распадаясь, образует 3 моль газа. Из закона Авогадро следует, что при уменьшении парциального давления ацетона на D р сумма парциальных давлений образовавшихся газов составит 3D р. Таким образом, можно записать P = p 0 – D p + 3× D p
Или 408 = 312 + 2× D p, D p = 48 мм рт.ст.
Следовательно, парциальное давление ацетона через 390 с после начала опыта составило 312 – 48 = 264 (мм. рт. ст.).
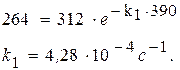 |
После подстановки в уравнение получим:
|
|