
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Высококалорийные горючие
|
|
Наибольшее количество тепла при сгорании (см. табл. 3.1) выделяют следующие 12 простых веществ (элементов):
металлы — литий, бериллий, магний, кальций, алюминии, титан и цирконий;
неметаллы — водород, бор, углерод, кремнии и фосфор.
К высококалорийным металлам следует отнести еще Nb, V, а также Sc и Y Эллерн приводит рецепты составов с ниобием и танталом. Дли ниобия Q2=1, 74, Q3=66.
Таблица 3.1
Теплота образования оксидов по данным работы
| Элемент | Оксид | Теплота образования, ккал | |||||||||||||||||||||||||||
| Символ | Атомный вес A | Формула | Молекулярный вес M | На моль оксида Q | Q1 | Q2 | Q3 | ||||||||||||||||||||||
| Металлы | |||||||||||||||||||||||||||||
| Li | б, | Li2O | 10, | 4... | 4, | ||||||||||||||||||||||||
| Be | 9, | BeO | 15, | 5, | |||||||||||||||||||||||||
| Mg | 24, | MgO | 5, | 3, 6 | |||||||||||||||||||||||||
| Аl | 27, | Al2O3 | 7, | 3, | 9 | ||||||||||||||||||||||||
| Ca | 40, | CaO | 3, | 2, | 7 | ||||||||||||||||||||||||
| Ti | 47, | TiO2 | 4, | 2, | |||||||||||||||||||||||||
| Zr | 91, | ZrO2 | 2, | 2, | |||||||||||||||||||||||||
| Неметаллы | |||||||||||||||||||||||||||||
| Н | 1, 0 | Н2О | 68, 4 | 34, 2 | 3, 8 | ||||||||||||||||||||||||
| (жидк.) | |||||||||||||||||||||||||||||
| C | 12, 0 | CO2 | 7, 8 | 2, 1 | |||||||||||||||||||||||||
| B | 10, 8 | B2O3 | 14, 0 | 4, 3 | |||||||||||||||||||||||||
| Si | 28, 1 | SiO2 | 7, 4 | 3, 5 | |||||||||||||||||||||||||
| Р | 31, 0 | P205 | 5, 9 | 2, 6 | |||||||||||||||||||||||||
| Примечание. Q=—H298. Для перехода к системе единиц СИ укажем со- | |||||||||||||||||||||||||||||
| отношение: 1 килокалория (ккал) ^4, 186 килоджоулей (кДж). | |||||||||||||||||||||||||||||
Характеристикой калорийности элементов служат величины Q1, Q2 и Q3.
Количество тепла Q1, выделяющееся при сгорании 1 г элемента простого вещества), служит мерилом калорийности горючего при его сгорании за счет кислорода воздуха.
Q1 выражается отношением Q/(m*A), где А— атомный вес, т— число атомов элемента, входящее в молекулу оксида.
Количество тепла Q2, выделяющееся при образовании 1 г оксида, может до некоторой степени служить мерилом калорийности для двойных смесей окислитель — горючее.
На рис. 3.1 показано, как изменяется значение Q2. для оксидов в зависимости от места, занимаемого элементом в периодической системе Д. И. Менделеева.
Количество тепла Qз, получаемое от деления Q а число атомов в молекуле оксида п, позволяет судить в известной мере о температуре горения элемента, так как в первом приближении она пропорциональна количеству тепла, которое приходится на 1 г-атом.
Наиболее высокую температуру при горении развивают цирконий, алюминий, магний, кальций и титан.
Значительно - более низкую температуру горения имеют водород, углерод, фосфор и литий.
В настоящее время из этих горючих в широких масштабах применяют только алюминий и магний и в несколько меньших - фосфор и уголь (углерод).
Основным высококалорийным пиротехническим горючим следует считать алюминий - элемент, содержащийся в большом количестве в земной коре (8, 8%); мировая добыча его в последние годы составляет 7-8 млн. т. в год.
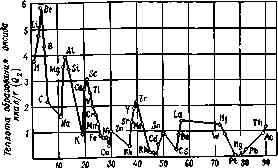
Порядковый номер элемента
Рис. 3.1. Зависимость теплоты образования оксида от порядкового номера элемента
Второе место принадлежит магнию, мировое производство которого выражается в сотнях тыс. т. в год. На рост магниевой промышленности большое влияние оказывает все увеличивающаяся потребность в магниевых сплавах, используемых в самолетостроении и в ракетной технике; техническое значение имеют магниевые сплавы с Al, Zn, Mn и Zr; магний используется также при изготовлении титана и циркония.
Бериллий - элемент, мало распространенный в земной коре (0, 0006%); добыча его руды (берилла) в капиталистических странах в 50-х годах XX века не превышала несколько тысяч тонн. Большим препятствием для практического его использования является весьма значительная токсичность бериллия, особенно в тонкодисперсном состоянии. Высокая температура кипения бериллия (около 2400° С) обусловливает трудность его испарения при горении. Бериллий относится к трудноокисляемым горючим.
Судя по патентным сообщениям, были попытки использовать порошок бериллия в твердом ракетном топливе.
Цирконий — дорогой и дефицитный материал, содержание его в земной коре невелико (0, 02%); составы с цирконием имеют высокую температуру горения и большую скорость горения. Используют цирконий главным образом в безгазовых и г-воспламенительных составах B малогабаритных изделиях. К достоинствам циркония следует отнести малое количество расходуемого на его сгорание кислорода и большую стойкость к коррозии. Тонкоизмельченный цирконий имеет черный цвет и по виду похож на уголь, он горит на воздухе, а также в атмосфере N2 или СОз. Взвесь порошка Zr в воздухе, содержащая 45- 300 мг/л, легко взрывается. Порошок циркония почти всегда содержит значительное количество гидрата ZrH2.
Титан при температуре 400-600° С может реагировать не только с кислородом, но и с азотом воздуха. Содержание титана в земной коре значительно (0, 6%). Мировое производство титана в 1968 г. составляло около 50 тыс. т. Пока еще титан дорог, но перспективы развития титановой промышленности велики.
Кальций не дорог и не дефицитен. Содержание его в земной коре велико (3, 6%), но производство его пока меньше, чем магния.
Использование в качестве горючего порошкообразного кальция связано с серьезными затруднениями, так как он при комнатной температуре энергично реагирует с влагой и кислородом воздуха. Проблематично применение кальция и в виде сплавов с другими металлами.
Содержание лития в земной коре мало (0, 006%). Применение в пиротехнике сплавов, заключающих в себе значительный процент лития, трудно осуществимо, так как литий чрезвычайно энергично реагирует с влагой и кислородом воздуха.
Водород применяется только в связанном состоянии в виде органических соединений.
Возможность применения в пиротехнике гидридов щелочных или щелочноземельных металлов является проблематичной по причине малой химической стойкости этих соединений; к недостаткам гидридов следует отнести также и их малую плотность.
Содержание бора в земной коре невелико (0, 001%), но мировое производство боратов и борной кислоты составляет сотни тысяч тонн в год.
Использование бороводородных топлив, являющихся более калорийными, чем обычные углеводороды, в ракетной технике одно время широко рекламировалось в США. Однако позже появилось сообщение, что производство их прекращено вследствие их высокой токсичности, трудности транспортировки, а также из-за их высокой стоимости.
Использование элементарного бора в пиротехнических составах связано с известными затруднениями: высокой температурой плавления (2050° С) и кипения (2550° С) бора, а также низкой температурой размягчения (около 450° С) оксида бора ВгОз. Последнее обстоятельство в известной степени препятствует получению высоких температур гари горении бора, так как тепло, выделяющееся при этом, в значительной мере затрачивается на плавление, а затем и на испарение оксида бора.
Скорость окисления бора в большой степени зависит от возможности быстрого удаления покрывающей его частицы оксидной пленки ВгОз.
Тонкоизмельченный (1 мкм) аморфный бор весьма реакционноспособен. По данным зарубежной печати он используется в безгазовых и специальных воспламенительных составах в малогабаритных изделиях.
Значительному применению в пиротехнике элементарного кремния препятствует его трудная воспламеняемость; возможно использование его в виде сплавов с магнием, алюминием или цирконием. По данным, тонкодисперсный порошок кремния может быть использован в безгазовых составах.
Наряду с калорийностью горючего, отнесенной к единице веса (см. табл. 3.1), в пиротехнике во многих случаях большое значение имеет количество тепла, выделяющееся при сгорании единицы объема горючего (Q4 ккал/см3). Такие данные приведены в табл. 3.2.
Таблица 3.2
Количество тепла в ккал, выделяющееся при сгорании 1 см3 некоторых горючих (Q4)
| Символ | Q4 | Символ | Q4 | Символ | Q4 | Символ | Q4 |
| Be | Zr | Nb | Та | ||||
| Al | B | Мо | Zn | ||||
| Mg | Si | Fe | W | ||||
| Ca | P белый | Mn | Ni | ||||
| Ti | 20 | Се |
Примечание. 1 ккал=4, 186 кДж.
По объемной калорийности первое место занимает бор (при расчете использована плотность 2, 3 г/см3), а тяжелые металлы Zr, Nb, Мо, Та и W имеют объемную калорийность, сравнимую с алюминием и значительно большую, чем у магния.
Объемная калорийность смесей горючее — окислитель, конечно, гораздо меньше, чем объемная калорийность горючих в отдельности. Из всех стехиометрических смесей наибольшую калорийность имеет смесь Be—LiC104 (см. приложение 3).
В табл. 3.3 приведены физико-химические свойства горючих и их оксидов.
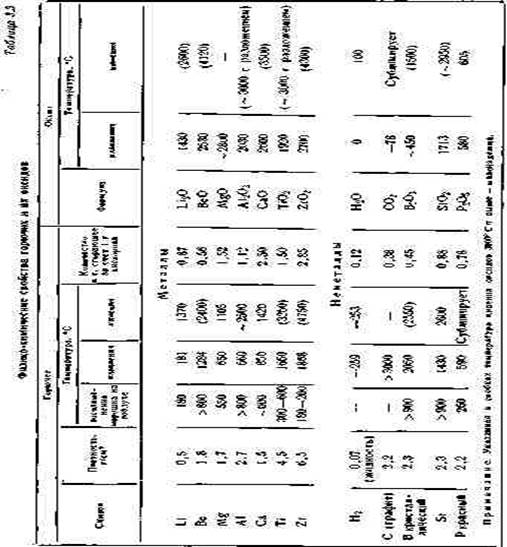
Температура воспламенения порошков металлов в очень большой степени зависит от размеров и формы частиц, а также качества покрывающей эти частицы оксидной пленки. Чем выше дисперсность порошка металла, тем ниже температура воспламенения.
Так, температура воспламенения порошка титана может варьировать в пределах 300-600° С, а некоторые образчики мелкодисперсного порошка циркония могут воспламеняться при комнатной температуре.
Увлажненный порошок циркония горит интенсивнее, чем сухой (система 2Н2О+Zr способна к горению и взрыву), а тушение горящего циркония допустимо только засыпкой порошкообразными СаF2 или СаО, так как Н20, ССl2, СО2 и даже СаСОз энергично реагируют с цирконием.
Известно, что при работе с тонкодисперсным порошком циркония (2-5 мкм) имели место несчастные случаи.
Отмечено, что температура воспламенения тонкодисперсного порошка циркония около 85° С. Он перевозится и, поскольку возможно, обрабатывается под водой.
Грубые фракции Zr-порошков имеют температуру воспламенения порядка 180—200° С.
Zr-порошок с размером частиц 10 мкм и более расценивается как малоопасный в обращении.
Наибольшего количества кислорода для окисления требуют водород и затем углерод при сгорании в СО2 (см. табл. 3.3). Отсюда следует, что составы, горючими в которых являются органические вещества, должны содержать в себе много окислителя и соответственно мало горючего.
Одним из основных факторов, определяющих химическую устойчивость металлов, является их стандартный электродный потенциал. Эти данные указаны в табл. 2.4.
Возможность окисления металлов газообразным кислородом при наличии трудноиспаряющегося оксида определяется качеством покрывающей металл оксидной пленки.
Согласно общеизвестному правилу Пиллинга и Бэдворса, если объем образующегося оксида меньше объема замещаемого им металла, то пленка оксида имеет рыхлую, ячеистую структуру и не может надежно защитить металл от дальнейшего окисления.
Если же отношение объема оксида к объему металла больше единицы, то образующаяся пленка имеет компактную, сплошную структуру, надежно изолирует металл от воздействия газообразного кислорода и, следовательно, препятствует дальнейшему окислению металла.
Коэффициент а Пиллинга и Бэдворса (см. табл. 3.4) вычисляется по формуле
MokDme
------------------
DokAme n...............= a
где Mok и Dok—молекулярный вес и плотность оксида;
Ame и Dme— атомный вес и плотность металла;
п — число атомов металла в формуле оксида.
Таблица 3.4 Отношение объема оксида к объему металла (а)
| Na | 0, 55 | А1 | 1, 45 | Си | 1, 70 |
| К | 0, 45 | Pb | 1, 31 | Ti | 1, 73 |
| Li | 0, 58 | Cd | 1, 32 | Fe | 2, 06 |
| Sr | 0, 69 | Sn | 1, 33 | Mn | 2, 07 |
| Ва | 0, 78 | Zr | 1, 45 | Co | 2, 10 |
| Са | 0, 64 | Zn | 1, 59 | Cr | 3, 92 |
| Mg | 0, 81 | Ni | 1, 68 | Si | 2, 04 |
Как видно из табл. 3.4, для легких металлов: щелочных, щелочноземельных и магния а< 1, для тяжелых металлов и алюминия а> 1.
Значение а определяет поведение металлов при высокотемпературной коррозии: если а< 1, то металл легко и быстро коррозирует.
Именно малое значение а для магния является одной из причин, определяющих большую скорость горения магниевых составов.
Вместе с тем известно, что при очень больших значениях а оксидный слой получает значительные внутренние напряжения, растрескивается и теряет защитные свойства, поэтому наибольшими защитными свойствами обладают оксидные пленки, для которых а не очень значительно превышает 1.
Наиболее важны для пиротехников свойства двух металлов: магния и алюминия.
Магний. Теплота плавления и кипения его равны соответственно 2, 1 и 30, 5 ккал (8, 8 и 128 кДж) г-атом (температуру плавления и кипения см. в табл. 3.3). Атомная теплоемкость для твердого и жидкого магния меняется с изменением температуры в пределах от 5, 9 до 8, 1 кал/г-атом (от 24 до 34 Дж/г-атом). Теплопроводность при 20° С 0, 37 кал/(см-с-град) 1, 55 Дж/(смХ Хс-гоал). Давление насыщенного паша в мм DT- сг- 1 ппи
662°'С, 20 при 750° С, 100 при 909° С (соответственно 130, 2600 и 13000Н/М2).
Химически магний весьма активен, но примерно до 350° С от окисления его в известной мере защищает оксидная пленка. При нагревании до более высокой температуры окисление магния ускоряется. Магний в виде крупных кусков и пластинок воспламеняется на воздухе при 600—650° С, порошкообразный — при температуре около 550C. При сгорании на воздухе магний образует оксид магния MgO и частично нитрид Mg3N2.
Известно, что добавление к воздуху 1 % по объему SiF4 или ВFз достаточно, чтобы потушить пламя горящего магния.
Оксид магния (MgO) — легкий белый порошок (плотность 3, 6 г/см3); сильно прокаленный оксид магния теряет способность соединяться с водой и растворяться в кислотах.
Летучесть MgO заметна при температуре около 2000° С; температура его плавления — около 2800° С. Большинство приводимых в литературе значений для температуры кипения MgO лежит в пределах 3000—3600° С. Следует полагать, что температура кипения MgO 'во всяком случае не ниже, чем 3100° С.. Скрытая теплота сублимации MgO оценивается величиной 150ккал/моль (627 кДж/моль).
Нитрид магния Mg3N2 — твердое вещество серо-зеленого цвета, легко разлагаемое водой: соединение магния с азотом сопровождается значительно меньшим выделением тепла, чем соединение его с кислородом.
Алюминий. Теплота плавления и кипения его равны соответственно 2, 5 и 69, 6 ккал/г-атом (10, 5 и 293 кДж/г-атом). Атомная теплоемкость изменяется с.изменением температуры от 0 до 1000° в пределах от 6, 0 до 7, 4 ккал/(г-атом-град) или от 25, 1 до 30, 9 Дж/(г-атом-град). Давление жара в мм рт. ст. (в скобках Н/м2): 2-Ю-5 (0, 003) при 660° С; 1 (130) при 1284° С; 20 (2600) при 1555° С и 100 (13000) при 1749° С. Теплопроводность при 20° С—0, 52 кал/(см-с-град), или 2, 17 Дж/(см-с-град).
Алюминий химически активен, но в обычных условиях (в том числе и в порошкообразном состоянии) окислению его препятствует тонкая, но прочная оксидная пленка. При накаливании порошкообразный алюминий энергично сгорает на воздухе. При температуре красного каления он активно соединяется с серой, образуя AlaSs. При 800° С алюминий соединяется с азотом, образуя нитрид A1N - белые кристаллы с температурой плавления 2200° С (при давлении азота 0, 4 МН/м2).
В своих соединениях алюминий трехвалентен, но при высоких температурах существуют соединения и одновалентного алюминия.
Оксид алюминия - белый порошок, имеющий плотность: корунд (а-А12О3) 3, 96, глинозем (у-Аl2О3) 3, 42 г/см3. Зависимость молярной теплоемкости в. интервале 100-1400° С от температуры для А120з выражается формулой: Ср = 23, 9 + 0, 0067 t.
Температура плавления Al2O3 2050° С. При высокой температуре (выше 2000° С) Аl2Oз в значительной степени диссоциирует с отщеплением кислорода, образуя низшие окислы — А1O, и в восстановительной атмосфере Аl2О, так что указываемая в справочниках температура кипения Аl2Оз является весьма условной.
Сплавы металлов. Из них следует особо указать на магниевоалюминиевые сплавы на рис. 3. 2.
Интерметаллическое соединение Mg4Al3 (54 вес. % магния) имеет теплоту образования + 49 ккал/моль (205 кДж/моль); плотность его 2, 15, температура плавления 463°С. Этот сплав выгодно отличается от соответствующих смесей магния с алюминием меньшей способностью к коррозии.
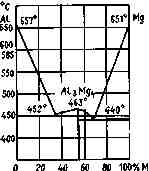
Рис. 3.2. Диаграмма состояния сплавов магний — алюминий обладает большой хрупкостью, что дает возможность легко осуществить процесс его измельчения.
В США для снаряжения фотобомб используется сплав Mg— А1 70/30,
Сплавы магния с алюминием, содержащие 85—90 % магния, получили название «электрон».
|
|