
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Препараты на основе акридонуксусной кислоты
|
|
Первоначально препарат циклоферон разработан с целью его применения в ветеринарии для лечения и профилактики вирусных заболеваний у домашних животных; одновременно проводились исследования по экспериментально-клиническому изучению циклоферона для внедрения в практику здравоохранения. Исследования показывают, что препарат обладает не только антивирусным и иммуномоделирующим свойствами, но и способен подавлять развитие ряда микробов. В их числе – возбудители туляремии, бруцеллеза, хламидийных инфекций и др. Отмечено ингибирующее действие лекарства на развитие инфекции ВИЧ и при лечении злокачественных опухолей. Испытания препарата показывают существенное улучшение состояния больных СПИДом с разными сроками заболевания [75, 77, 78]. В настоящее время ведется разработка препаратов на основе солей акридонуксусной кислоты, которые обладают направленным противовирусным действием [79, 80]. Соль акридонуксусной кислоты в сочетании с N, N-диметиламиноизопропил глюкозой (препарат анандин) используется при лечении тяжелых вирусных инфекций и в том числе при лечении геморрагической лихорадки с почечным синдромом.
При введении в организм данного препарата наблюдается выраженная противовирусная активность (не только профилактическая, но и лечебная) как в отношении ДНК- (вирусы герпеса простого 1-го и 2-го серотипов, вирус осповакцины), так и РНК- (вирусы японского и клещевого энцефалитов, вирус венесуэльского энцефаломиелита, вирус лихорадки долины Рифт, вирусы гриппа А и Б) геномных вирусов [60].
Натриевая соль 10-карбоксиметил-9-акриданона (КМА) (препарат неовир) проявляет аналогичное действие относительно вирусных инфекций, вызываемых РНК- и ДНК-содержащими вирусами за счет индукции синтеза эндогенного интерферона α /β в высоких титрах. КМА под торговым названием камедон применяют в ветеринарной практике, а под названием неовир – в медицине [81].
Синтезированное позднее соединение - литиевая соль 10-карбоксиметил-9-акриданона - виролит, обладает более широким спектром активности по сравнению с его прототипом – неовиром. Относительно низкая токсичность и низкая цена виролита позволяют широко использовать данный препарат для лечения и профилактики инфекционных болезней, а в комбинации с другими лекарствами – для усиления действия последних, снижения или устранения резистентности микроорганизма к ним и т.д. [60].
На кафедре экологии СГТУ в течение ряда лет изучалась биологическая активность следующих соединений акридонового ряда [рисунок 6]:
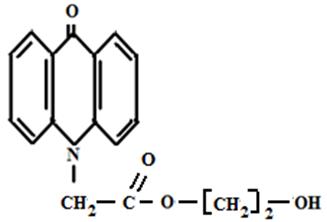
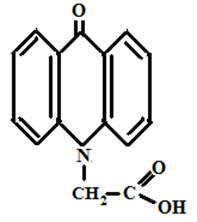
Эфир АУК и полиэтиленгликоля Акридон-N-уксусная кислота
(АУК)
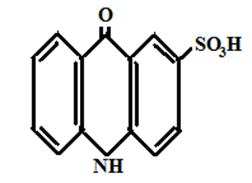
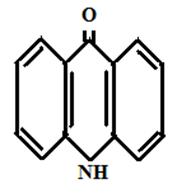
Акридон-2-сульфокислота Акридон
(АСК)
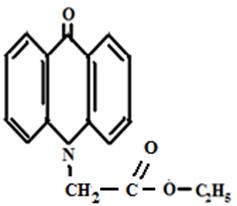
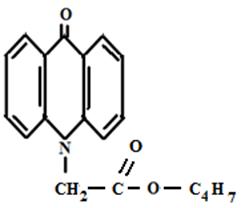
Этиловый эфир АУК Бутиловый эфир АУК
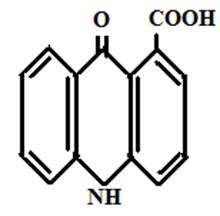
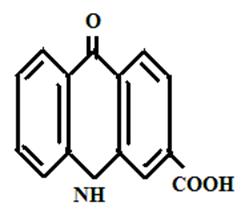
1- карбоксиакридон 3-карбоксиакридон
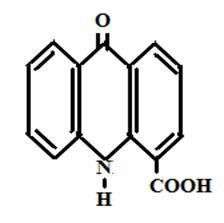

4-карбоксиакридон
Рисунок 6 Производные акридона
Изучена бактериостатическая активность указанных веществ на фитопатогенные бактерии Xanthomonas campestris B-610, Pseudomonas syringae B-1546 и Erwinia carotovora subsp. atrullis -603. Установлено, что из всех протестированных соединений АСК является единственным веществом, проявившим бактериостатический эффект на исследованные микроорганизмы. Поэтому оно, как наиболее перспективное, было отобрано для дальнейших исследований.
Выявлена бактерицидная активность водных растворов АСК в концентрациях от 1· 10-1 до 8· 10-4 г/л в отношении названных фитопатогенов и определен интервал концентраций рабочих растворов данного соединения.
Изучено действие АСК на живые системы: на одно-и двудольные растения (пшеницу, овес, рожь, огурцы, кабачки и горох), на инфузории, дафнии, крыс.
Определено влияние концентраций водных растворов АСК от 8· 10-2 до 8· 10-6 г/л на прорастание семян однодольных и двудольных растений. Установлено, что длины корней проростков растений, выращенных в присутствии данного вещества, превосходят контрольные показатели в 1, 5-2 раза. Максимальные значения длин корней проростков отмечались в присутствии следующих концентраций АСК: 8· 10-2 г/л для пшеницы, овса, гороха и кабачков, 8· 10-4 г/л для ржи и 8· 10-6 г/л для огурцов.
Определены зоны роста корней проростков семян пшеницы и гороха. Растворы АСК активизируют разные зоны роста корней однодольных и двудольных растений. У однодольных растений АСК стимулируют зону растяжения корней, а у двудольных – зону меристематических клеток.
Для установления связи между структурой соединения и его -активностью проведены квантово-химические расчеты пространственной, электронной структуры молекул и QSAR-свойств для четырех веществ акридона, АСК, акридон-N-уксусной и для индолил-3-уксусной кислот, два из которых (АСК и ИУК) обладают высокой рострегулирующей активностью.
Установлено, что различие в биологической активности данных соединений не связано с распределением электронной плотности в основной части молекул. Анализ других квантовохимических (пространственных, электронных) и QSAR-дескрипторов не позволили выявить явных отличий между исследуемыми соединениями. Молекулу АСК отличает от остальных соединений этого ряда только высокое значение дипольного момента. Авторы предполагают, что имеет место электростатическое удерживание молекулы АСК вблизи рецептора, активного центра фермента и т.п., что обуславливает ее сравнительно высокую биологическую активность. Для АСК и ИУК структурного подобия не найдено, т.е. имеет место иной механизм рострегулирующего действия у АСК.
Изучено токсическое действие АСК на на инфузории, дафнии и крысы. Проведено биотестирование водных растворов АСК на тест-объектах: инфузориях Stilonichia mytilus и дафниях Daphnia magna Straus. Изучено влияние водных растворов АСК в действующих концентрациях (8· 10-2, 8· 10-3, 8· 10-4, 8· 10-5, 8· 10-6 г/л) и в сверхмалых дозах (8· 10-13, 8· 10-14, 8· 10-15, 8· 10-16, 8· 10-17 г/л). Определение токсичности водных растворов АСК показало, что гибель клеток инфузорий вызывает лишь наивысшая действующая концентрация (8· 10-2 г/л), остальные концентрации соединения не проявили токсического действия на данный объект.
Эксперимент на дафниях тех же концентраций АСК показал, что только одна концентрация АСК - 8· 10-2 г/л снижает плодовитость дафний и их выживаемость. Это свидетельствует о проявлении хронической токсичности соединения.
Проведены исследования по определению острой токсичности растворов АСК на белых беспородных крысах. Определено значение LD50, равное 1800мг/кг, что позволяет оценить соединение как малотоксичное.
С помощью ядрышкового теста на клетках апикальной меристемы корней лука (Allium cepa Liliaceae) оценена мутагенная активность растворов АСК в концентрациях (8· 10-2, 8· 10-3, 8· 10-4, 8· 10-5, 8· 10-6 г/л) и установлено, что изучаемое соединение не проявляет мутагенной активности.
Таким образом, авторами установлено, что АСК оказывает бактерицидный эффект в отношении фитопатогенов и выраженное действие на скорость прорастания однодольных и двудольных растений и при этом обладает низкой токсичностью. Кроме того, вещество не представляет генетической опасности. Все это свидетельствует о перспективности дальнейших исследований АСК с целью создания на ее основе препарата для защиты растений.
1.7 Новые O-, N-, S-, содержащие гетероциклические соединения – новые объекты в исследованиях пестицидов
Известно, что гидрированные азолы, азины и фурилалкилкарбамиды являются биологически активными веществами широкого спектра действия. Ранее авторами [65, 87, ] проведен анализ данных компьютерного прогнозирования вероятности проявления медико-биологической активности в ряду некоторых синтезированных соединений данного ряда, который показал, что они представляют интерес как потенциальные нейро- и ноотропные средства, антибиотические вещества, иммуномодуляторы, регуляторы ферментативной активности и морфогенеза.[87] Перечисленные виды биологического действия представляют приоритетные направления создания новых лекарственных препаратов и средств защиты растений, что предопределило наши исследования в плане поиска путей практического использования полученных соединений.
Теоретическим обоснованием изучения росторегулирующей и морфогенетической активности явилось структурное соответствие объектов исследования природным и синтетическим цитокининам – фитогормонам, интенсифицирующим клеточное деление.
Представители синтезированных рядов азолов, азинов и тиомочевин прошли многоступенчатый скрининг в условиях лабораторных опытов в отношении зерновых и овощных в ФГОУ ВПО «Саратовский государственный аграрный университет им. Н. И. Вавилова».
Исследование росторегулирующей активности азолов и азинов проводили на пшенице «Саратовская – 29». Установлено, что предпосевная обработка семян растворами тестируемых веществ в концентрациях 10-3 – 10-4 % оказала существенное влияние на улучшение биометрических показателей и стимуляцию синтеза белка[88].
Изучение влияния предпосевной обработки семян промышленных сортов овощных культур водными суспензиями тестируемых препаратов в концентрациях 10-2 – 10-3 % показало повышение устойчивости последних к заболеваниям грибковой этиологии (бактериоз, мучнистая роса). Степень иммунизирующего эффекта в некоторых случаях превосходила таковую эталонов (фундазол, биоцин)[89].
Проведены полевые испытания росторегулирующей активности бутилфурилмочевины и дибутилфурилмочевины на следующих культурах: люцерне сорта «Зайкевича» и «Медиа», томатах сорта «Новичок», пшенице сорта Саратовская -29. Семена растений обрабатывались в течение 20 часов растворами фурилзамещенных мочевин в концентрациях 10 -3 % и 10 -4 % [90].
Результаты испытаний показали, что фурилалкилкарбамиды бутилфурилмочевины и дибутилфурилмочевины стимулируют прцессы клеточного метаболизма, что приводит к положительному морфогенезу- формированию мощной корневой системы и наземной части растений, обеспечивает их быстрый рост и развитие в стадиях вегитации, цветения, колошения, плодоношения [91]. Установлено, что в результате морфогенетического и иммуномоделирующего действия бутилфурилмочевины и дибутилфурилмочевины имеет место увеличение общей и товарной урожайности, повышение устойчивости растений к заболеваниям вирусной и грибковой этиологии, что ведет к повышению уровня рентабельности производства овощных, зерновых и кормовых культур [87].
Установлено что все тестированные соединения являются малотоксичными и оказывают умеренное антимикробное действие, задерживая рост тест-микробов в концентрациях 100-6.25 мкг/ мл. Наиболее выраженным является действие в отношении кишечной палочки (МИК 12.5-6.25 мкг/ мл). Для некоторых соединений наряду с бактериостатическим обнаружен бактерицидный эффект (МИК 12.5-25 мкг/ мл) [89].
Таким образом, показано, что соединения изучаемых рядов обладают выраженной морфогенетической активностью, являются биостимуляторами и иммунизаторами зерновых культур. Поэтому представляет интерес продолжить исследования биологического действия новых O-, N-, S-гетеросодержащих соединений, синтезированных на кафедре органической и биоорганической химии СГУ.
|
|