
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Структура коллоидных растворов
|
|
Коллоидные растворы - высокодисперсные (микрогетерогенные) структурированные системы с твердыми частицами, размером 2 мкм и менее.
Твердые (коллоидные) частницы – нерастворимые микроагрегаты, состоящие из атомов с прочными ковалентными связями, обладающие гидрофильностью (активным взаимодействием с молекулами воды). Гидрофильные функциональные группы представляют собой группы анионов с высокоотрицательными атомами (чаще всего кислорода) и катионов. Гидро 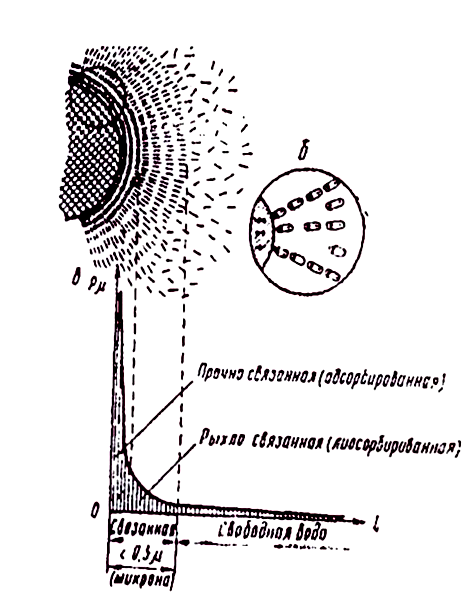 фильность группы определяют по формуле Полинга
фильность группы определяют по формуле Полинга
E=  (1.1)
(1.1)
где Э1- высоко электроотрицательные атомы анионов, н - число анионов в группе, Э2 – катион,
Благодаря гидрофильности функциональных групп коллоидные частицы образуют гидрогенную структуру. Гидрогенная структура – это система с утойчивыми связями молекул воды с гидрофильной твердой фазой.
Рис. 1.3. Схема молекулярного взаимодействия сил в системе: твердая частица – вода (по Н.А.. Цытовичу):
а – схема строения лиосорбной воды; б – расположение диполей воды вокруг электрически заряженной частицы; в – эпюра изменений величины молекулярных сил в зависимости от расстояния до поверхности минеральной частицы.
В соответсвии с эксперементальнными исследованиями взаимодействия воды с глинистыми частицами грунтоведы Н.А.Цитович и Е.М. Сергеев установили, что коллоидные частицы под воздействием их поверхностной энергии 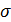 (межмолекулярных и электростатических сил) активно адсобируют молекулы воды (рис 1.3)
(межмолекулярных и электростатических сил) активно адсобируют молекулы воды (рис 1.3)
Под воздействием поверхностной энергии частиц вокруг них образуется плотный (гидратный) слой молекул (диполей) воды.
По исследованиям Н.А. Цитовича толщина гидратного слоя может составлять более пятисот нанометров. По словам академика Б.В. Дерягина слой прочносвязанной воды обладает высокой прочностью, плотностью, вязкостью и низкой температурой замерзания. У самой поверхности прочность связей молекул воды с твердым телом может достигать сотен мегапаскалей, плотность до 1500 кг/ 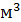 , температура замерзания до -78° c и ниже.
, температура замерзания до -78° c и ниже.
Суммарную энергию взаимодействия молекул воды с функциональными группами коллоидных частиц, можно выразить суммой межмолекулярного (ориентационного) взаимодействия молекул-диполей воды и диполей функциональных групп частиц, с одной стороны и электростатического взаимодействия отрицательно заряженных частиц с молекулами (диполями) воды (иондипольного взаимодействия) с другой стороны.
 =
= 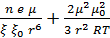 (1.2),
(1.2),
где e – заряд частицы, n – число зарядов, 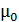 - дипольный момент функциональной группы, μ – диполный момент молекул воды, r – расстояние между частицами и точкой измерения,
- дипольный момент функциональной группы, μ – диполный момент молекул воды, r – расстояние между частицами и точкой измерения, 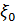 - электрическая постоянная,
- электрическая постоянная, 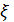 – диэлектрическая проницаемость.
– диэлектрическая проницаемость.
Из формулы видно, что с удалением от частицы силы межмолекулярного взаимодействия, при постоянной температуре, очень быстро понижается до нуля
f = 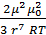 (1.3)
(1.3)
электростатическое взаимодействие снижается значительно медленее:
f = 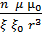
(1.4)
Для разбавленных растворов в связи со значительными расстояними между частицами и молекулами воды будет действовать только электростатическое взаимодействие, а межмолекулярное взаимодействие будет равным нулю. Для концентрированных – пренимущественно межмолекулярное взаимодействие
Расстояние между частицами можно определить исходя из геометрических соображений
r= 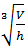 =
= 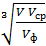 =
= 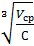 , (1.5)
, (1.5)
где V – объем коллоидного раствора, n – число частиц дисперсной фазы, 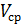 - объем одной (усредненной) частицы, Vф- объем всех частиц, С – концентрация дисперсной фазы.
- объем одной (усредненной) частицы, Vф- объем всех частиц, С – концентрация дисперсной фазы.
Подставляя значения r в формулу (1.3) получим
f = 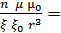
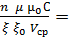
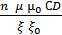 (1.6)
(1.6)
т.е. для разбавленных коллоидных растворов прочность структуры будет прямо пропорциональна концентрации дисперсной фазы и ее дисперсности.
В концентрированных коллоидных растворах частицы твердой фазы распологаются на малых расстояниях, на которых действуют межмолекулярные силы
f = 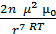 ,
,
(1.7)
подставляя в формулу (1.3) значение “r” получим:
f = 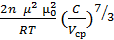 . (1.8)
. (1.8)
Результаты эксперементальных исследований подтверждают справедливость приведенных расчетов. Расстояния между частицами (толщину гидратного слоя) можно определить по формуле
2r = 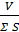 , (1.9)
, (1.9)
где v – объем раствора, S – суммарная поверхность всех частиц твердой фазы
Таким образом, гидрофильность (сумммарное взаимодействие всех частиц твердой фазы с молекулами воды) коллоидного раствора прямо пропорциональна активности твердой фазы, колличеству активных диполей – коллоидных частиц (функциональныъх групп с высоко электроотрицательными атомами) и дисперсности твердой фазы.
Практически гидрофильность коллоидного раствора можно определять по его осмотическому давлению.
Для этого необходимо приготовить емкость с полупроницаемой перегородкой (рис 1.4), в левую полость которой-1 заливаем чистую воду, а в правую-2 исследуемый раствор
Осмотическое давление определяем по разности уровня жидкости в левой и правой емкостей
1 Рис 1.4
|
|