
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Часть 2. Газообразные нейромодуляторы.
|
|
- Монооксид азота (NO).
 Монооксид азота (NO) – первое газообразное вещество, для которого было показано участие в процессах межклеточной коммуникации.
Монооксид азота (NO) – первое газообразное вещество, для которого было показано участие в процессах межклеточной коммуникации.
Поскольку монооксид азота – это газ, который легко растворяется как в воде, так и в жирах, он не может накапливаться и храниться в синаптических пузырьках. Косвенным следствием этого является тот факт, что NO не высвобождается посредством Ca2+-зависимого экзоцитоза везикул, а просто диффундирует из цитозоля, где он синтезируется, во внеклеточное пространство. При этом выделение газа не привязано к какой-либо части нервной клетки.
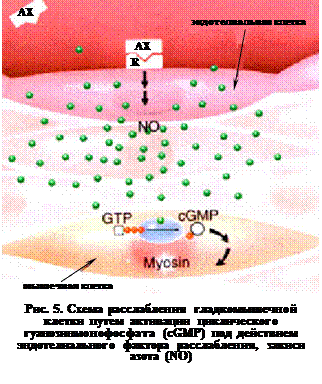
В качестве паракринного передатчика сигнала монооксид азота впервые был охарактеризован в 1980 г. Р. Фернчгот и Дж. Завадский впервые показали, что т. н. эндотелиальный фактор, расcлабляющий сосуды, есть NO. Взаимодействие АХ с поверхностными рецепторами клеток эндотелия приводит к синтезу в них монооксида азота, диффундирующего к прилежащим гладкомышечным клеткам стенки сосуда, вызывая их расслабление, т. е. расширение кровеносного сосуда (рис. 5).
Представления о роли NO как нейромодулятора сформировались только в конце 80-х гг. ХХ в., когда были получены доказательства его действия в нервной ткани.
Локализация NO-ергических нейронов в ЦНС. Существует целый ряд трудностей, наличие которых в течение длительного времени осложняло картирование NO-продуцирующих нейронов:
ü NO не хранится в синаптических пузырьках, он синтезируется «по мере надобности» в ответ на поступающие извне сигналы,
ü концентрация крайне мала,
ü время жизни также невелико, что затрудняет уже прямое детектирование in vivo.
В большинстве случаев в качестве маркера возможной продукции NO клетками выступает NADPH-диафораза, один из ко-факторов синтеза монооксида азота. Кроме того, эффективным способом картирования NO-ергических нейронов является использование флуоресцентных красителей, способных специфически связываться с молекулой монооксида азота.
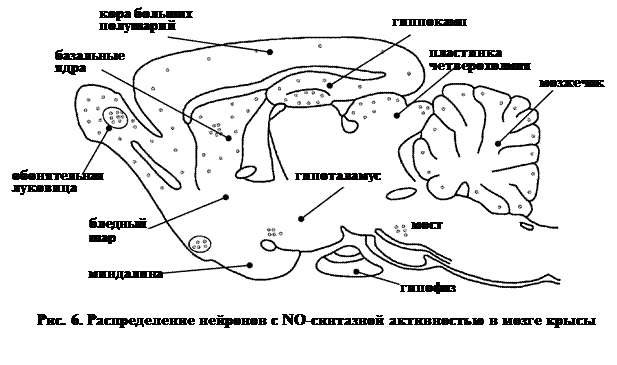
В ЦНС удается выявить все три формы NO-синтазы (см. далее). Нитрергические клетки широко представлены (рис. 6) среди:
ü нейронов обонятельной луковицы,
ü гипоталамуса (супраоптическое ядро),
ü коры больших полушарий,
ü гиппокампа,
ü базальных ядер (хвостатое ядро и скорлупа),
ü пластины четверохолмия среднего мозга,
ü мозжечка,
ü ядер ствола.
Имеются свидетельства о продукции NO клетками глии, а также его ко-локализации с ГАМК и нейропептидом Y.
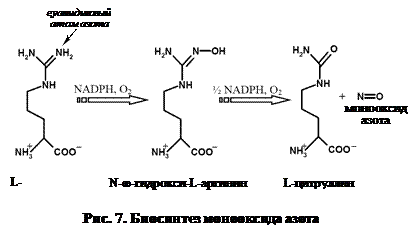 Метаболизм NO. Монооксид азота образуется в результате двустадийного окисления гуанидинового атома азота в молекуле незаменимой аминокислоты L-аргинина. Промежуточным продуктом реакции является N-ω -гидрокси-L-аргинин, распадающийся с образованием одной молекулы цитруллина и монооксида азота (рис. 7). Продукция NO в мозге не особенно интенсивна – пмоль/мин/мг общего белка.
Метаболизм NO. Монооксид азота образуется в результате двустадийного окисления гуанидинового атома азота в молекуле незаменимой аминокислоты L-аргинина. Промежуточным продуктом реакции является N-ω -гидрокси-L-аргинин, распадающийся с образованием одной молекулы цитруллина и монооксида азота (рис. 7). Продукция NO в мозге не особенно интенсивна – пмоль/мин/мг общего белка.
Выделяемый клеткой NO связывается со своими мишенями, а его избыток быстро инактивируется при взаимодействии с кислородом или супероксид-анионом ( ключевая активная форма кислорода (О2-), образующаяся при присоединении одного электрона к молекуле кислорода в основном состоянии) – время жизни свободного NO исчисляется несколькими секундами. Монооксид азота способен образовывать комплексы с белками крови, в частности с гемоглобином, и это еще один путь его инактивации. Заметим, что для газообразных нейромодуляторов не существует специальной системы обратного захвата или распада.
Из NO может образовываться пероксинитрит – крайне реакционное соединение, способное индуцировать свободно-радикальные реакции и обладающее выраженными нейротоксическими свойствами. Пероксинитрит – сильный окислитель (ONOO-) образуется при взаимодействии NO с O2:
NO + O2 = ONOO-
Пероксинитрит способен окислять NH- и SH-группы белков, что приводит, в частности, к инактивации игибиторов некоторых ферментов. В клетках ONOO- индуцирует процессы перекисного окисления липидов в мембранах и вызывает однонитевые разрывы в ДНК.
Фермент NO-синтаза. Протекание реакции синтеза обеспечивает фермент NO-синтаза (NOS). Данные фермент был назван синтазой, а не синтетазой, поскольку его работа не требует энергии АТФ.
Существует три основные изоформы данного фермента:
ü нейронная (nNOS),
ü эндотелиальная (eNOS),
ü индуцибильная (iNOS).
 При этом активность первых двух форм регулируется внутриклеточными ионами кальция. При повышении их концентрации происходит образование комплекса кальция с кальмодулином, который, взаимодействуя с NO-синтазой, переводит ее в активное состояние. Для нормального протекания реакции требуется также ряд кофакторов – NADPH и кислород. Снижение уровня кальция в клетке приводит к терминации синтеза монооксида азота в нейронах и эндотелии.
При этом активность первых двух форм регулируется внутриклеточными ионами кальция. При повышении их концентрации происходит образование комплекса кальция с кальмодулином, который, взаимодействуя с NO-синтазой, переводит ее в активное состояние. Для нормального протекания реакции требуется также ряд кофакторов – NADPH и кислород. Снижение уровня кальция в клетке приводит к терминации синтеза монооксида азота в нейронах и эндотелии.
Индуцибильная форма NOS встречается в клетках периферической крови, выполняющих защитную функцию (макрофаги). Благодаря своим свободнорадикальным свойствам NO в данном случае выступает в роли цитотоксического агента.
В мозге повышение внутриклеточной концентрации кальция происходит вследствие предварительной активации NMDA-рецепторов. Напротив, в клетках эндотелия реализуется механизм, связанный со стимуляцией фосфолипазы С и активацией IP3/DAG-пути.
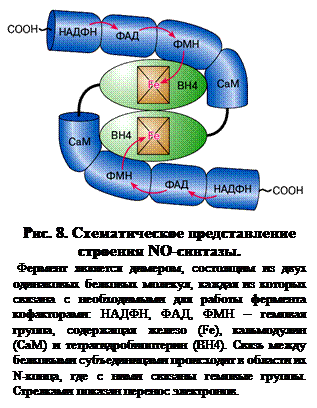
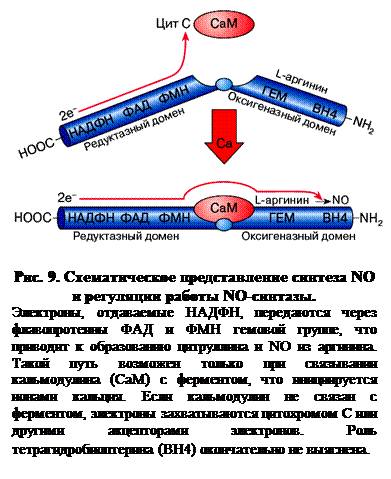 NO-синтаза – это сложно устроенный фермент, представляющий собой гомодимер, состоящий из двух одинаковых белковых субъединиц, к каждой из которых присоединено несколько кофакторов, определяющих каталитические свойства фермента (рис. 8). Активность фермента проявляется только при объединении двух его субъединиц.
NO-синтаза – это сложно устроенный фермент, представляющий собой гомодимер, состоящий из двух одинаковых белковых субъединиц, к каждой из которых присоединено несколько кофакторов, определяющих каталитические свойства фермента (рис. 8). Активность фермента проявляется только при объединении двух его субъединиц.
Одним из важных кофакторов является внутриклеточный кальцийсвязывающий белок кальмодулин. При повышении содержания ионов кальция в клетке он присоединяется к молекуле NO-синтазы, что приводит к активации фермента и синтезу NО (рис. 9). Такое свойство фермента имеет большое значение для клеток, поскольку ферментативная активность, а значит, и синтез NО прямо зависят от функционального состояния клетки, определяющегося во многом внутриклеточным уровнем ионов кальция – высокоактивных посредников, влияющих на многие процессы в клетках. Среди других регуляторных механизмов фермента следует отметить возможность фосфорилирования белковой части молекулы и влияние особых белков, участвующих в связывании двух субъединиц фермента в единый функционально активный комплекс.
Механизм внутриклеточной передачи сигнала. Монооксид азота легко проникает через мембраны любых клеток. Таким образом, он не связывается ни с какими рецепторами на поверхности клетки, а взаимодействует непосредственно с внутриклеточными белками.
 Основной мишенью действия NO в клетке является растворимая гуанилатциклаза, катализирующая образование цГМФ из ГТФ. Связывание монооксида азота с гемом гуанилатциклазы приводит к изменениям конформации последней, что и лежит в основе ее активации. Образующийся цГМФ, в свою очередь, стимулирует цГМФ-зависимую протеинкиназу, способную фосфорилировать многочисленные белки, в том числе белки ионных каналов (рис. 10).
Основной мишенью действия NO в клетке является растворимая гуанилатциклаза, катализирующая образование цГМФ из ГТФ. Связывание монооксида азота с гемом гуанилатциклазы приводит к изменениям конформации последней, что и лежит в основе ее активации. Образующийся цГМФ, в свою очередь, стимулирует цГМФ-зависимую протеинкиназу, способную фосфорилировать многочисленные белки, в том числе белки ионных каналов (рис. 10).
В частности, в клетках гладких мышц фосфорилирование посредством цГМФ-зависимой протеинкиназы модулирует активность К+- и Ca2+-каналов, а также кальциевых насосов, что приводит к уменьшению внутриклеточной концентрации кальция и опосредует расслабление мышцы.
Биологические эффекты монооксида азота. Благодаря своим особенностям NO является активным участником несинаптических взаимодействий, опосредуя передачу сигнала на бó льшие, по сравнению с шириной синаптической щели, расстояния.
В пределах ЦНС монооксид азота участвует в:
ü регуляции мозгового кровообращения,
ü высвобождении нейромедиаторов и нейромодуляторов,
ü процессах нейрогенеза,
ü процессах синаптической пластичности.
Особенно стоит отметить роль NO в развитии долговременной потенциации (ДВП) в нейронах коры больших полушарий и гиппокампа, а также долговременной депрессии (ДВД) – снижении эффективности проведения возбуждения через синапс – в нейронах мозжечка.
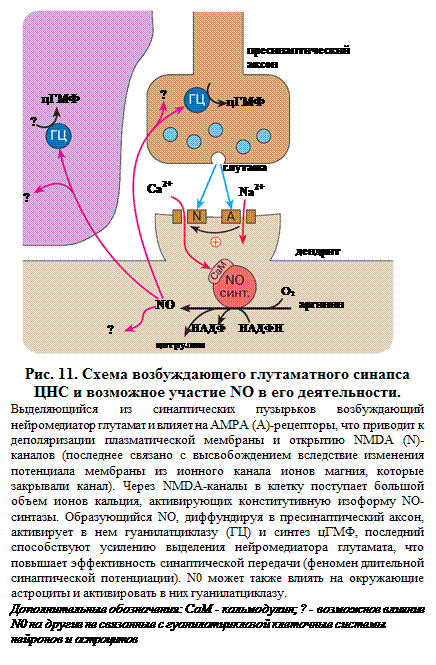
В первом случае – при возникновении ДВП – возбуждение постсинаптического окончания приводит к повышению внутриклеточного уровня Са2+/кальмодулина, активирующих NO-синтазу и образование NО. NО, диффундируя в пресинаптическое окончание, вызывает образование цГМФ, что приводит к усилению и увеличению длительности выделения из пресинапса нейромедиатора, который, в свою очередь, оказывает возбуждающее действие на постсинаптический нейрон и таким образом возникает обратная положительная связь с постоянным усилением. Такому механизму особое внимание уделяется в синапсах с наиболее распространенным и сильным возбуждающим нейромедиатором ЦНС глутаматом и особому глутаматному рецептору – NMDA-рецептору, являющемуся трансмембранным каналом для ионов кальция (рис. 11).
 Помимо NO-зависимой формы ДВП существуют некоторые долговременные изменения синаптической передачи, которые не подвержены регуляторному влиянию монооксида азота (NO-независимая ДВП, рассмотрены в предыдущей лекции).
Помимо NO-зависимой формы ДВП существуют некоторые долговременные изменения синаптической передачи, которые не подвержены регуляторному влиянию монооксида азота (NO-независимая ДВП, рассмотрены в предыдущей лекции).
Длительную синаптическую депрессию, в частности в контактах между параллельными волокнами, являющимися аксонами самых маленьких нейронов в организме человека, так называемых клеток-зерен, и нейронами Пуркинье в коре мозжечке связывают с десенсибилизацией другого класса глутаматных рецепторов, так называемых АМРА-рецепторов (открывают каналы для ионов Na+ и Са2+, что способствует быстрой деполяризации мембран).
Выделяющийся из аксонов корзинчатых нейронов (особый тип нейронов коры мозжечка) NО диффундирует к нейронам Пуркинье и активирует в них синтез цГМФ, что приводит к инактивации АМРА-рецепторов и снижению эффективности работы синапсов между клетками зернами и нейронами Пуркинье.
В основе первого положения NO-гипотезы лежит возможность образования NО в постсинаптическом окончании при его возбуждении и влияние газа на пресинаптический аксон. Однако за счет диффузии к соседним нервным клеткам NО может оказывать влияние не только на пресинаптическое расширение аксона, формирующего синапс на этом постсинаптическом окончании, но и на близлежащие аксоны и дендриты, модулируя их активность (рис. 12).
Традиционная формулировка положения об участии NО в межнейронной коммуникации ограничивается обычно возможностью синтеза и выделения NО из локальной области нейрона – постсинаптического окончания. Однако, как показывают результаты свето- и электронно-микроскопических исследований, NО-синтаза определяется во всем объеме тела нейронов – в перикарионе, аксоне и дендритах. Поскольку при возбуждении нейрона по всей длине его отростков и в теле уровень кальция циклически колеблется (образуются своеобразные кальциевые волны), можно считать, что синтез и выделение NО могут инициироваться в любом участке тела и отростков нейронов. Таким образом, нейроны, содержащие NO-синтазу, способны создавать вокруг себя поле воздействия, то есть могут считаться своеобразными полевыми нейронами в отличие от традиционных нейронов, связанных друг с другом в локальных участках – синапсах.
Основное внимание в процессах синаптической пластичности уделяется, конечно, нейронам, однако нельзя не учитывать и роль глии. Известно, что астроциты способны продуцировать NО. Если принять во внимание, что число астроцитов в 10-100 раз превосходит (в зависимости от области мозга) количество нейронов, то их роль в продукции NО и влиянии на механизмы электрогенеза нейронов может является весьма значимой.
Значение астроцитов как источника NО особенно ярко проявляется при патологии ЦНС. При многих нейродегенеративных заболеваниях, ишемии, травмах, опухолях головного мозга астроциты начинают экспрессировать NO-синтазу и продуцировать большой объем NО. С этим связывают гибель нейронов и других макроглиальных клеток, в частности одигодендроцитов.
Известно и о нейропротекторных свойствах монооксида азота. Так, нейроны, содержащие NO-синтазу, устойчивее к нейротоксическому действию глутамата.
С другой стороны, гиперпродукция NO, например, при развитии кислородного голодания (ишемии) мозга, может вызывать повреждение расположенных рядом с источником его синтеза клеток.
Кроме того, NO, принимает участие в развитии нервной системы. Целенаправленный рост и ветвление отростков нейронов, установление новых синаптических контактов в процессе развития нервной системы во многом определяются возбуждением нервных клеток. Нейроны, содержащие NO-синтазу, обнаружены еще в эмбриональном периоде, и, как полагают, NО может инициировать разветвление растущих аксонных и дендритных веточек и стимулировать образование синапсов. Эта область нейробиологии остается еще малоисследованной.
- Монооксид углерода (СO) и сульфид водорода (Н2S).
Роль других эндогенных газообразных веществ в регуляции процессов межклеточной коммуникации менее значима, нежели NO.
Монооксид углерода. Образование СО катализируется гемоксидазой (HO), активирующейся при фосфорилировании протеинкиназой С. При этом монооксид углерода является побочным продуктом реакции распада гема до биливердина. Известно о существовании двух изоформ гемоксидазы:
ü эндотелиальная (HO1): индуцибильный фермент, ответственный за распад гема. Его экспрессия возрастает в ответ на аккумуляцию гема и при действии окислительного стресса;
ü нейронная (НО2): конститутивный фермент, встречается в мозге.
Как и NO, монооксид углерода легко проникает через клеточные мембраны, связывается с железом гема в гуанилатциклазе, активируя ее и стимулируя продукцию цГМФ.
Монооксид углерода выступает в качестве ретроградного передатчика при развитии ДВП. Он также модулирует работу глутаматергических систем мозга, участвует в регуляции хемосенсоров каротидных телец, вызывает вазодилятацию.
Сульфид водорода. Эндогенный H2S образуется из аминокислоты цистеина под действием пиридоксаль-5’-фосфат-зависимых ферментов: цистатион β -синтазы (СВS) и цистатион γ -лиазы (CSE).
В настоящее время нельзя с уверенностью сказать, в какой форме сульфид водорода активен в тканях: Н2S, HS– или S2–. Поэтому термин «сульфид водорода» одинаково применим ко всем формам. В физиологических растворах одна треть сульфида водорода существует в недиссоциированной форме (Н2S), а другие две трети приходятся на долю HS–.
В норме продукция H2S в гомогенатах мозга составляет около 20 нмоль/мин/G-белок. В результате эндогенная концентрация H2S в мозге достигает уровня в 50–160 мкМ. В отличие от NO и CO, сульфид водорода не увеличивает уровень цГМФ, а напрямую взаимодействует с участками белков, содержащих дисульфидные связи, в частности, в NMDA-рецепторах, или свободные тиоловые группы.
Известно, что высокие концентрации H2S (> 320 мкМ) угнетают синаптическую передачу в гиппокампе. В то же время в физиологических концентрациях дисульфид водорода облегчает ДВП в гиппокампальных нейронах за счет усиления ответов, опосредованных активацией NMDA-рецепторов.
|
|