
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Выполнение работы.
|
|
Получение золя гидроксида железа (III)
100–150 мл дистиллированной воды нагревают в стакане до кипения. Затем в кипящую воду постепенно при нагревании добавляют 5-10 мл 2%-ного раствора FeCl3, доводят до кипения. Полученный коллоидный раствор гидроксида железа (III) желто-коричневого цвета осторожно охлаждают до комнатной температуры. Приготовленный золь используют для определения порога коагуляции электролитов и для наблюдения электрофореза.
Определение порога коагуляции золя электролитами
В двенадцать чистых пробирок наливают, используя пипетки, указанные в таблице 1 объемы дистиллированной воды и растворов электролитов.
Во все пробирки добавляют по 5 мл охлажденного до комнатной температуры золя. Содержимое пробирок хорошо перемешивают.
Через 1 час отмечают, в каких пробирках наблюдается явная коагуляция (помутнение) и седиментация. Результаты наблюдений заносят в таблицу 1: в строке напротив соответствующего электролита записывают «+», если коагуляция наблюдается, «–», если коллоидный раствор в пробирке прозрачен.
Таблица 1
| № пробирки | |||||||
| Золь гидроксида железа (III), мл | |||||||
| Дистиллированная вода, мл | 4, 5 | ||||||
| Раствор электролита, мл | 0, 5 | ||||||
| Результат наблюдения через 30-50 мин («+» - если есть помутнение или осадок и «–» - если коагуляция не наблюдается) | |||||||
| KCl | |||||||
| K2SO4 | |||||||
| K3[Fe(CN)6] | |||||||
Для каждого электролита отмечают наименьший объем, при добавлении которого наблюдалась коагуляция золя.
Обработка результатов.
Порог коагуляции выражается в миллимолях электролита на литр коллоидного раствора (ммоль/л). Порог коагуляции вычисляют по формуле: 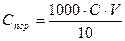 ,
,
где С – концентрация раствора добавленного электролита, моль/л, V – наименьшее число миллилитров раствора электролита, достаточное для коагуляции золя, мл, 10 – суммарный объем золя после добавления электролита, мл (см. таблицу 1).
Вычисляют порог коагуляции для каждого электролита и результаты записывают в таблицу 2.
Таблица 2
| Электролит | Коагулирующий ион | Порог коагуляции |
| KCl | ||
| K2SO4 | ||
| K3[Fe(CN)6] |
Контрольные вопросы.
1. Какой заряд имеют гранулы золя Fe(OH)3?
2. Чем отличается коллоидно-дисперсные системы от истинных растворов и грубодисперсных систем?
3. В чем заключается явление коагуляции?
4. В чем заключается явление седиментации?
5. Что такое порог коагуляции и как его можно определить экспериментально?
6. В чем заключается правило Шульце-Гарди?
7. Что такое коллоидная защита?
8. Взаимная коагуляция (самостоятельно)
|
|