
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Визначення маси карбонату натрію (соди) в розчині
|
|
Якість соди залежить від змісту карбонату натрію. Залежно від способу добування вона містить домішки NaCl, Na2SO4, нерозчинний залишок та ін. Безводна сода є дуже гігроскопічна речовина.
Сутність методу. Карбонат натрію, будучи сіллю дуже слабкої вугільної кислоти і сильної основи гідроксиду натрію, дуже легко піддається гідролізу:
Na2CO3 + HOH = NaHCO3 + NaOH
CO32- + HOH = HCO3¯ + OH¯
Внаслідок цього розчин карбонату натрію має лужну реакцію. При кип'ятінні розчину соди гідроліз її може протікати до кінця внаслідок леткості вуглекислого газу
Na2CO3 + HOH = 2NaОН + СO2↑
При титруванні розчину соди кислотою спостерігається два стрибки, що видно з хімічних рівнянь.
Na2CO3 + H2SO4 = NaHCO3 + NaHSO4 (перший стрибок – I)
2NaHCO3 + H2SO4 = Na2SO4 + 2HOH + 2CO2↑ (другий стрибок – II)
Таким чином, при титруванні розчину соди при кип'ятінні можна застосовувати індикатор фенолфталеїн. При титруванні на холоді в присутності фенолфталеїну процес нейтралізації можна зафіксувати тільки до утворення NaHCO3 (І). Кисла сіль, що утворюється, не дає можливості дисоціювати фенолфталеїн як кислоту й тим самим перешкоджає його переходу в сольову форму. Молярна маса еквівалента карбонату натрію при титруванні його розчину на холоді в присутності фенолфталеїну дорівнює:
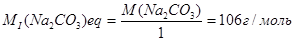
У присутності метилового жовтогарячого (метилового червоного) процес нейтралізації карбонату може бути зафіксований до повного розкладання NаНСО3 – до утворення Н2СО3 (II). Молярна маса еквівалента карбонату натрію при титруванні його розчину в присутності метилового жовтогарячого (метилового червоного) дорівнює:
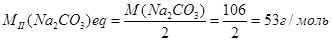
Цю властивість соди дуже часто використовують при аналізі соди в присутності з іншими речовинами (NaHCO3, NaOH).
Методика визначення. Отриманий розчин карбонату натрію в мірній колбі розбавляють декарбонізованою дистильованою водою до мітки, перемішують. Бюретку заповнюють атестованим розчиномH2SO4. Піпеткою Мора відбирають 10 мл розчину соди в колбу для титрування й туди ж додають 1-2 краплі метилового червоного (метилового жовтогарячого). Титрують розчином H2SO4до зміни забарвлення розчину з жовтого (жовтогарячого) до блідо-рожевого. Титрування проводять не менше трьох разів. Отримані результати титрування записують у робочий журнал. Об'єми розчину сірчаної кислоти, що витрачають на титрування, повинні відрізнятися не більше ніж на 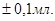 Розраховують середнє арифметичне значення об'єму (Vcеp) розчину сірчаної кислоти, що пішов на титрування.
Розраховують середнє арифметичне значення об'єму (Vcеp) розчину сірчаної кислоти, що пішов на титрування.
| № п/п | V(Н2SO4), мл | V(Na2CO3), мл |
Vcер =
Обчислення. Масу карбонату натрію в аналізованому розчині розраховують за формулою:
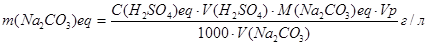 ,
,
де 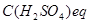 − молярна концентрація еквівалента атестованого розчину сірчаної кислоти, моль/л;
− молярна концентрація еквівалента атестованого розчину сірчаної кислоти, моль/л;
V(H2SO4) – середній об'єм розчину сірчаної кислоти, що пішов на титрування, мл;
Vр - об'єм мірної колби з карбонатом натрію (соди), мл;
V(Na2CO3) – об'єм розчину соди, відібраного на аналіз (аліквоти), мл.
Контрольні запитання
1. Сформулюйте сутність кислотно-основного титрування.
2. Які речовини застосовують як стандартні у кислотно-основному
титруванні?
3. Що називається кривою титрування?
4. Що називається стрибком титрування?
5. Від яких факторів залежить величина стрибка титрування?
6. В якому середовищі буде відбуватись:
а) стрибок титрування слабкої кислоти сильною основою?
б) стрибок титрування слабкої основи сильною кислотою?
7. Сутність іонно-хромофорної теорії індикаторів.
8. Які індикатори застосовують у методі кислотно-основного титрування?
9. Що називають інтервалом переходу індикатора?
10. В чому сутність правила вибору індикатора у кислотно-основному методі?
11. Що таке показник титрування індикатора?
12. Фосфорна кислота триосновна. Чому її титрують тільки як одноосновну
або двоосновну?
13. Що можна визначити, знаючи константу дисоціації індикатора?
14. Що є аналітичним сигналом у методі титрування?
15. Як розрахувати відносну похибку визначення?
|
|