
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Чем меньше значение тем более сильным является основание.
|
|
Для кислоты и сопряженного ей основания в разбавленном водном растворе справедливо равенство:
Kw = Ka · Kв
где Kw – ионное произведение воды.
Кислотные свойства вещества в растворе зависят не только от его способности отдавать ион Н+, но и от способности молекул растворителя его принять. Так хлороводород при растворении в воде практически полностью распадается на ионы, а его растворы в бензоле, наоборот, не содержат ионов и не проводят электрический ток.
Чем больше у растворителя сродство к протону, тем легче диссоциирует в нем кислота. Растворители с ярко выраженным сродством к ионам Н+ называются протофильными.
В таких растворителях (жидкий NH3, гидразин) даже очень слабые в водных растворах кислоты: HCN, H2S – являются сильными.
Растворители, обладающие гораздо большей способностью к отдаче протона, чем к его присоединению называются протогенными. К ним относятся: ледяная уксусная кислота, концентрированная (100%) H2SO4 и др. В их среде затрудняется диссоциация кислот, но облегчается ионизация оснований.
Растворители, обладающие сравнимой способностью к присоединению или отдаче ионов Н+ называются амфипротными. К ним относятся Н2О, насыщенные одноатомные спирты (СН3ОН, С2Н5ОН) и т.д.).
Существуют также апротонные или инертные растворители: бензол, толуол, CCl4, дихлорэтан и др. Способность присоединять или отщеплять от себя ион Н+ у них выражена очень слабо. В их среде кислоты и основания практически не диссоциируют.
Таким образом, в теории кислот и оснований Бренстеда-Лоури понятия кислоты и основания относятся лишь к функции, которую выполняет рассматриваемое соединение в том или ином процессе. Одно и тоже вещество может в одних условиях проявлять себя как кислота, а в других – как основание. Например, в водных растворах СН3СООН ведет себя как кислота:
СН3СООН + Н2О ↔ СН3СОО– + Н3О+
а в 100% H2SO4 – как основание
СН3СООН + H2SO4 ↔ HSO4– + СН3СООН2+
Таким образом, в системе из двух способных взаимодействовать с протоном веществ основанием всегда служит то, которое его прочнее связывает, т.е. характеризуется большим протонным сродством.
Все реакции кислотно-основного взаимодействия (ионизации, нейтрализации, гидролиза) согласно теории Бренстеда-Лоури состоят в обратимом переносе протона от кислоты к основанию, вследствие чего их часто называют протолитическими. В результате такого взаимодействия образуется пара новых частиц: одна из которых опять способна отдавать протон (сопряженная кислота), а другая его присоединять (сопряженное основание). Таким образом кислота оказывается в равновесии с сопряженным основанием, а основание с сопряженной кислотой:
| НА | + | В | ↔ | ВН+ | + | А– |
| кислота | основание | сопряженная кислота | сопряженное основание |
Данный процесс называется кислотно-основным равновесием. До наступления равновесия он преимущественно протекает в сторону образования более слабой кислоты и основания.
Рассмотрим примеры некоторых протолитических реакций.
1. Реакция ионизации:
| СН3СООН | + | Н2О | ↔ | СН3СОО– | + | Н3О+ |
| кислота | основание | сопряженное основание | сопряженная кислота |
Реакция, протекающая в прямом направлении является реакцией ионизации уксусной кислоты, а в обратном направлении – реакцией нейтрализации основания (ацетат-иона) кислотой.
Равновесие данного обратимого процесса в значительной степени смещено влево, т.к. СН3СООН и Н2О являются более слабыми кислотой и основанием, чем Н3О+ и СН3СОО– (табл. 13).
2. Реакция гидролиза:
| СН3СОО– | + | Н2О | ↔ | СН3СООН | + | ОH– |
| основание | кислота | сопряженная кислота | сопряженное основание |
Данная прямая реакция является реакцией гидролиза ацетат-иона, а обратная – реакцией нейтрализации уксусной кислоты сильным основанием ОН–.
Более слабыми кислотой и основанием являются Н2О и СН3СОО– (табл. 13) и поэтому в данном обратимом процессе обратная реакция превалирует над прямой.
Теория Бренстеда-Лоури хоть и является более совершенной чем теория Аррениуса, однако тоже имеет определенные недостатки и не является всеобъемлющей. Так она неприменима ко многим веществам, проявляющим функцию кислоты, но не содержащих в своем составе ионов Н+, например: BCl3, AlCl3, BF3, FeCl3 и др.
В 1923 г. Г.Н. Льюисом была выдвинута электронная теория кислот и оснований, в которой кислотные свойства соединения вообще не связываются с наличием в нем ионов водорода.
 Гильберт Нильтон Льюис (1875 —1946). Американский физикохимик. Его работы связаны с химической термодинамикой и теорией строения вещества. Ввел в термодинамике понятие активности, разработал теорию обобщенных электронных пар в моделях ковалентной связи (структуры Льюиса). В 1926 г. практически одновременно с Бренстедом и Лоури предложил новую концепцию кислот и оснований, в которой основой является передача электронной пары: кислоты Льюиса — акцепторы, а основания Льюиса — доноры электронной пары. В 1930-х гг. Льюис разработал метод получения тяжелой воды.
Гильберт Нильтон Льюис (1875 —1946). Американский физикохимик. Его работы связаны с химической термодинамикой и теорией строения вещества. Ввел в термодинамике понятие активности, разработал теорию обобщенных электронных пар в моделях ковалентной связи (структуры Льюиса). В 1926 г. практически одновременно с Бренстедом и Лоури предложил новую концепцию кислот и оснований, в которой основой является передача электронной пары: кислоты Льюиса — акцепторы, а основания Льюиса — доноры электронной пары. В 1930-х гг. Льюис разработал метод получения тяжелой воды.
Кислотой по Льюису является частица (молекула или ион), способная присоединять электронную пару (акцептор электронной пары). Она должна содержать в своем составе атом с незаполненной до октета внешней электронной оболочкой: BF3, AlCl3, BeCl2, H+, Cu2+ и т.д.
Основанием является частица (молекула или ион), способная предоставлять для образования связи электронную пару (донор электронной пары). Основание по Льюису должно содержать в своем составе атом с неподеленной электронной парой на внешнем слое:: NH3,: NH2–NH2,: OH–,: Cl–.
Согласно теории Льюиса кислота и основание взаимодействуют друг с другом с образованием ковалентной связи по донорно-акцепторному механизму:
 А А
| + | : В | → |  А: В А: В
|
| кислота | основание | кислотно-основной комплекс |
 BF3 BF3
| + | : NH3 | → |  F3B: NH3 F3B: NH3
|
| кислота | основание |
 H+ H+
| + | Н2О: | → | Н3О+ |
| кислота | основание |
Теория Льюиса не противоречит теории Бренстеда-Лоури. Понятие основания в обеих этих теориях практически совпадает, однако понятие кислоты в концепции Льюиса значительно шире и охватывает кроме иона Н+ многие другие электроноакцепторные частицы, в том числе и катионы металлов Men+. Соответственно значительно увеличивается и число реакций, которые по своему характеру относятся к кислотно-основному взаимодействию. Так, например, согласно теории Льюиса кислотно-основными являются многочисленные реакции комплексообразования:
| Cu2+ | + | 4NН3 | → | [Cu(NН3)4]2+ |
| кислота | основание |
Теория Льюиса широко используется для объяснения реакционной способности органических соединений и очень удобна при описании механизма химических реакций, протекающих с их участием.
Общая характеристика III аналитической группы
Гидроксиды бария, кальция, стронция являются сильными основаниями, и растворимые соли их, образованные сильными кислотами, гидролизу не подвергаются.
Хорошо растворимыми солями этих катионов являются хлориды, нитраты, ацетаты.
Карбонаты, сульфаты, хроматы, оксалаты и фосфаты – трудно растворимые.
Групповым реактивом на катионы III группы является разбавленная серная кислота.
Действие группового реактива H2SO4
Разбавленная серная кислота с катионами кальция, бария, стронция образует белые осадки сульфатов. Эти осадки практически нерастворимы в воде, в щелочах и кислотах. Но растворимость их в воде сильно отличается. Так, Ks (ВaSO4) = 1·10‾ 10; Ks (CaSO4) = 2, 5·10‾ 5; Ks (SrSO4) = 2, 8·10‾ 7.
Из этого следует, что при действии серной кислоты на разбавленные растворы солей катионов данной группы, бария сульфат выпадает мгновенно, стронция сульфат – постепенно, сульфат же кальция образуется только при нагревании очень медленно, так как произведение концентраций ионов кальция и сульфат-ионов не достигает величины константы растворимости кальция сульфата (для понижения растворимости CaSO4 необходимо добавить ацетон или спирт).
BaCl2 + H2SO4 → BaSO4↓ + 2 HCl
Ba2+ + SO42‾ → BaSO4↓
мелкокристаллический
SrCl2 + H2SO4 → SrSO4↓ + 2 HCl
Sr2+ + SO42‾ → SrSO4↓
аморфный
ацетон
 CaCl2 + H2SO4 CaSO4↓ + 2 HCl
CaCl2 + H2SO4 CaSO4↓ + 2 HCl
Ca2+ + SO42‾ → CaSO4↓
кристаллический
В отличие от BaSO4 и SrSO4 растворимость кальция сульфата в значительной степени повышается в присутствии аммония сульфата. При этом образуется очень неустойчивая комплексная соль состава (NH4)2[Ca(SO4)2]:
CaSO4 + (NH4)2SO4 → (NH4)2[Ca(SO4)2]
Отсюда следует, что если осаждение смеси катионов Ba2+, Sr2+ и Ca2+ производить не серной кислотой, а избытком раствора (NH4)2SO4, то осаждения ионов кальция не происходит, однако при нагревании осадок CaSO4 образуется быстро.
Предел обнаружения бария – 0, 08 мкг, кальция – 1 мкг.
Так как сульфаты бария, стронция не растворяются ни в кислотах, ни в щелочах, а между тем открытие (обнаружение) их ионов нужно проводить из раствора, необходимо уметь переводить сульфаты бария, стронция в такие состояния, которые могут быть в дальнейшем растворимы в кислоте. Этого можно достигнуть, переводя сульфаты в карбонаты.
ОПЫТ: берут три пробирки; в одну из них добавляют по 5 капель раствора соли бария, в другую – соли кальция, в третью – соли стронция. В каждую пробирку добавляют 1-2 капли 2 н. раствора серной кислоты. Наблюдают образование осадков. Осадок кальция сульфата выпадает только в присутствии спирта или ацетона.
Перевод сульфатов в карбонаты проводят следующим образом: к осадку, например, бария сульфата прибавляют насыщенный раствор натрия карбоната и кипятят, затем центрифугируют и центрифугат отбрасывают.
Такую обработку проводят 5-8 раз. После этого осадок растворяют в уксусной кислоте. Если осадок растворяется почти полностью, это говорит о том, что бария сульфат переведен в карбонат.
t
BaSO4 + (NH4)2CO3 (насыщ.) → BaCO3 ↓ + (NH4)2SO4
BaSO4 + CO32‾ → BaCO3 + SO42·
Превращение BaSO4 в BaCO3 происходит, если выполняется условие:
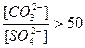
|
|