
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вывод формулы для вычисления рН в растворах слабых кислот в присутствии их солей
|
|
 |
 HA H+ + A-
HA H+ + A-
MA = M+ + A-
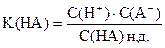
Из уравнения диссоциации
С(A-)» С(МA)
С(HA) н.д.» С(HA)
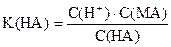
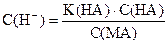
- lg С(Н+) = (- lg K(НА)) + (- lg С(НА)) - (- lg С(MА))
 |
pН = pK(НА) + pС(НА) - pС(MА)
Примеры расчета
1. К 20 мл 0, 1н раствора CH3COOH прилито 10 мл 0, 1н раствора КОН.
Вычислить рН в полученном растворе.
| Дано: Сн (CH3COOH) = 0, 1 моль/л V (CH3COOH) = 20 мл Сн (КОН) = 0, 1 моль/л V (КОН) = 10 мл K (CH3COOH) = 1, 74× 10-5 |
| рН =? |
Решение:
CH3COOH + КОН = CH3COOK + H2O
1) Сколько милли-моль-эквивалентов CH3COOH содержится в 20 мл раствора
0, 1 × 20 = 2
2) Сколько милли-моль-эквивалентов КОН содержится в 10 мл раствора
0, 1 × 10 = 1
Столько же милли-моль-эквивалентов CH3COOK содержится в растворе.
3) Сколько милли-моль-эквивалентов CH3COOH содержится в избытке
2 - 1 = 1
4) Вычислить общий объем
20 + 10 = 30
5) Вычислить концентрации CH3COOH и CH3COOK после смешивания
Сн (CH3COOH) = 1/30 = 0, 03
Сн (CH3COOK) = 1/30 = 0, 03
6) Вычислить pH раствора
pН = pK(CH3COOH) + pС(CH3COOH) - pС(CH3COOK)
pK(CH3COOH) = - lg 1, 74× 10-5 = (- lg 1, 74) + (- lg 10-5) = 5 - 0, 24 = 4, 76
pС(CH3COOH) = - lg 0, 03 = - lg 3× 10-2 = (- lg 3) + (- lg 10-2) = 2 - 0, 48 = 1, 52
pС(CH3COOK) = - lg 0, 03 = - lg 3× 10-2 = (- lg 3) + (- lg 10-2) = 2 - 0, 48 = 1, 52
pН = 4, 76 + 1, 52 - 1, 52 = 4, 76
слабокислая среда
2. К 100 мл 0, 2н раствора HCOOH прибавлено 50 мл 0, 5н раствора HCOONa.
Вычислить рН смеси.
| Дано: Сн (HCOOH) = 0, 2 моль/л V (HCOOH) = 100 мл Сн (HCOONa) = 0, 5 моль/л V (HCOONa) = 50 мл K (HCOOH) = 1, 8× 10-4 |
| рН =? |
Решение:
1) Сколько милли-моль-эквивалентов HCOOH содержится в 100 мл раствора
0, 2 × 100 = 20
2) Сколько милли-моль-эквивалентов HCOONa содержится в 50 мл раствора
0, 5 × 50 = 25
3) Вычислить общий объем
100 + 50 = 150
4) Вычислить концентрации HCOOH и HCOONa после смешивания
Сн (HCOOH) = 20/150 = 0, 13
Сн (HCOONa) = 25/150 = 0, 17
5) Вычислить pH смеси
pН = pK(HCOOH) + pС(HCOOH) - pС(HCOONa)
pK(HCOOH) = - lg 1, 8× 10-4 = (- lg 1, 8) + (- lg 10-4) = 4 - 0, 26 = 3, 74
pС(HCOOH) = - lg 0, 13 = - lg 1, 3× 10-1 = (- lg 1, 3) + (- lg 10-1) = 1 - 0, 11 = 0, 89
pС(HCOONa) = - lg 0, 17 = - lg 1, 7× 10-1 = (- lg 1, 7) + (- lg 10-1) = 1 - 0, 23 = 0, 77
pН = 3, 74 + 0, 89 - 0, 77 = 3, 86
среда кислая
|
|