
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Связь между универсальной и удельной газовыми постоянными. Уравнения состояния идеального и реального газов (примеры).
|
|
R=Rμ /μ =8314/μ (Дж/кгК), где 8314 – универсальная газовая постоянная; R – удельная газовая постоянная (Дж/кгК); μ - молекулярная масса. Пример: Rвозд=8314/28, 96=287, (Дж/кгК) Идеальный газ - научная абстракция при которой полагается, что молекулы не имеют объема (считаются материальными точками) и отсутствуют силы межмолекулярного взаимодействия (силы взаимного притяжения, отталкивания). Любой газ до 3 МПа можно условно считать идеальным, а до 50 МПа – с погрешностью. 1) уравнение Менделеева–Клапейрона: Рν =RT, где Т – абсолютная термодинамическая температура (К); ν - удельный объем: ν =W/m, (м3/кг), где W –объем; m- масса; Р –абсолютное давление; РW= mRT; R=Rμ /μ => РW=mTRμ /μ, где m/μ =N – число Кмолей; РW=NRμ T=8314NT. При высоких давлениях или очень низких температурах все газы не подчиняются уравнению Менделеева – Клапейрона, в этом случае используя уравнение состояния реального газа: 1) ур. Ван Дер-Ваальса: (Р+а/v2)(v-b)=RT, где a и b – константы; (а/v2) – поправка на межмолекулярные взаимодействия; b –поправка на собственный объем молекул. Из уравнения Ван Дер-Ваальса для высоких давлений и температур (> 2000 K) пренебрегая поправкой (а/v2) получаем уравнение Дюпре: Р((1/ρ)-b)=RT. 2) Ур. Майера-Богомолова: 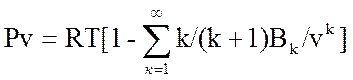 PV=RT[1-∑ (k/(k+1))*(Bk/vk)], для низких давлений, разряжений к=1 =>
PV=RT[1-∑ (k/(k+1))*(Bk/vk)], для низких давлений, разряжений к=1 => 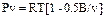 PV=RT[1-0.5B/V], где Вк – вириальный коэф. 3) ур. Вукаловича-Новикова (Ур. Водяного пара): Рv=RT[1-(A/V)-(B/V2)], где А и В – эмпирические коэф. Для водяного пара составлены таблицы и номограммы. 4) ур. Состояния с вириальными коэффициентами: Pv=Во+(В1/v1)+ (В2/v2)+….., Во, В1, В2 – соответственно 0, 1, 2 – вириальные коэффициенты.
PV=RT[1-0.5B/V], где Вк – вириальный коэф. 3) ур. Вукаловича-Новикова (Ур. Водяного пара): Рv=RT[1-(A/V)-(B/V2)], где А и В – эмпирические коэф. Для водяного пара составлены таблицы и номограммы. 4) ур. Состояния с вириальными коэффициентами: Pv=Во+(В1/v1)+ (В2/v2)+….., Во, В1, В2 – соответственно 0, 1, 2 – вириальные коэффициенты.
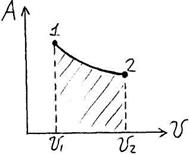
14. Теплота, работа и внутренняя энергия в простейших процессах (формулы). Простейшие процесс или изо процессы – это процессы, где какой то один из параметров (Р, Т, S, v) поддерживается постоянным. 1) В изохорном процессе v=const, Аv=0, из общей формулы работа: 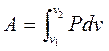 A=∫ v2v1Pdv. (Работа - площадь под кривой), где Р абсолютное давление в (Па).
A=∫ v2v1Pdv. (Работа - площадь под кривой), где Р абсолютное давление в (Па).
По 1-у закону термодинамики: Qv=∆ Uv; Изменение внутренней энергии:  Δ Uv=Cv(T2-T1), где
Δ Uv=Cv(T2-T1), где 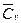 - средняя удельная изохорная теплоемкость в диапазоне от начальной температуры Т1 до конечной температуры Т2; 2) Изобарный процесс. Работа Ар=Р(v2-v1), где v1 и v2 – удельный начальный и конечный объемы; Теплота
- средняя удельная изохорная теплоемкость в диапазоне от начальной температуры Т1 до конечной температуры Т2; 2) Изобарный процесс. Работа Ар=Р(v2-v1), где v1 и v2 – удельный начальный и конечный объемы; Теплота 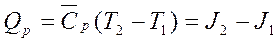 Qp=Cp(T2-T1)=J2-J1, где
Qp=Cp(T2-T1)=J2-J1, где 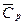 - средняя удельная изобарная теплоемкость; J2-J1 – удельные энтальпии системы в начальном и конечном состоянии. (Используются в диаграммах: JS (для пара) и Jd (для влажного воздуха)). Изменение внутренней энергии:
- средняя удельная изобарная теплоемкость; J2-J1 – удельные энтальпии системы в начальном и конечном состоянии. (Используются в диаграммах: JS (для пара) и Jd (для влажного воздуха)). Изменение внутренней энергии: 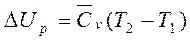 Δ Up=Cv(T2-T1); 3) Изотермический процесс Т=const, ∆ U=0. QT=AT – теплота идет на совершение работы; Работа АТ=RTln(P1/P2)=RTln(v2/v1); 4) Адиабатный процесс – процесс без теплообмена с окружающей средой: энтропия S=const, dQ=0, As=-∆ Us – работа совершается за счет внутренней энергии системы. Изменение внутренней энергии:
Δ Up=Cv(T2-T1); 3) Изотермический процесс Т=const, ∆ U=0. QT=AT – теплота идет на совершение работы; Работа АТ=RTln(P1/P2)=RTln(v2/v1); 4) Адиабатный процесс – процесс без теплообмена с окружающей средой: энтропия S=const, dQ=0, As=-∆ Us – работа совершается за счет внутренней энергии системы. Изменение внутренней энергии: 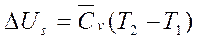 Δ Us=Cv(T2-T1); Работа: As=(P1v1-P2v2)/(K-1) или As= RT/(K-1)[1-(P2/P1)(k-1)/k)].
Δ Us=Cv(T2-T1); Работа: As=(P1v1-P2v2)/(K-1) или As= RT/(K-1)[1-(P2/P1)(k-1)/k)].
|
|