
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Определение бихроматной окисляемости
|
|
Оборудование и реактивы:
1) Бихромат калия K2Cr2O7, 0, 25моль-экв/л (0, 25н) раствор. Навеску K2Cr2O7 массой 12, 258г переносят в мерную колбу на 1л, растворяют в воде и доводят объем раствора до метки.
2) Тиосульфат натрия Na2S2O3, 0, 2моль-экв/л (0, 2н) раствор. Навеску Na2S2O3´ 5Н2О массой 49, 64г растворяют в воде в мерной колбе на 1л. Устанавливать нормальность раствора тиосульфата следует не раньше, чем через 10 дней после его приготовления. Если раствор приготовлен на свежекипяченой дистиллированной воде, нормальность его можно устанавливать через 1-2 дня после приготовления.
3) Йодид калия KI, 20% раствор.
4) Крахмал, 1% раствор.
5) Серная кислота Н2SО4 4н раствор.
Ход работы:
В колбу Эрленмейра на 250мл помещают 50мл анализируемой воды, прибавляют 10мл 4н серной кислоты и 10мл 0, 25н бихромата калия. В колбу вносят кипелки (стеклянные капилляры или кусочки пористой керамики), накрывают воронкой для предотвращения разбрызгивания, нагревают до кипения и кипятят в течение 10 мин. Переносят колбу в баню с холодной водой и охлаждают до комнатной температуры. К охлажденному раствору приливают 3мл 20%-ного раствора йодида калия, накрывают часовым стеклом, осторожно перемешивают и помещают на 5мин. в темное место для завершения реакции. Выделившийся йод оттитровывают раствором тиосульфата натрия в присутствии индикатора – крахмала, который добавляют после того, как бурая окраска посветлеет. Если переход окраски в конце титрования плохо заметен, перед прибавлением крахмала раствор можно разбавить 50мл дистиллированной воды.
Холостой опыт выполняют аналогично с 50мл дистиллированной воды. Все определения выполняются не менее двух раз.
Окисляемость (ХПК) анализируемой воды в мг О2/л вычисляют по формуле:
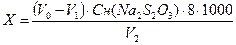 ,
,
где V0 – расход раствора тиосульфата натрия на титрование холостой пробы, мл;
V1 – расход раствора тиосульфата натрия на титрование рабочей пробы, мл;
V2 – объем анализируемой пробы воды, мл;
Cн(Na2S2O3) – нормальность раствора тиосульфата натрия, моль-экв/л;
8 – эквивалент кислорода, г/моль-экв.
Для сравнения определяют перманганатную окисляемость водопроводной воды, которую желательно предварительно отстоять в течении двух часов. Объем пробы водопроводной воды для анализа берут 50 мл. Остальное аналогично предыдущему.
(Лурье, 1984)
Контрольные вопросы
1. Что называют ² окисляемостью² воды?
2. Содержание, каких веществ в воде определяет величину окисляемости воды?
3. В каких случаях определяют перманганатную окисляемость воды?
4. В каких пределах изменяется окисляемость природных вод?
5. Какие факторы окружающей среды влияют на окисляемость поверхностных вод?
6. Что называют теоретическим ХПК сточных вод?
7. Какие окислители используют при экспериментальном определении ХПК сточных вод?
8. Что называют биологическим потреблением сточных вод БПК?
|
|