
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Процессы выветривания
|
|
Поверхность земной коры подвержена действию атмосферы, что делает ее восприимчивой к физическим и химическим процессам. Физическое выветривание является механическим процессом, в результате которого порода размельчается до частиц меньшего размера без существенных изменений в химическом составе. Когда сдерживающее давление коры устраняется поднятием и эрозией, устраняются и внутренние напряжения в пределах подстилающих пород, позволяя расширившимся трещинам открыться. Эти трещины могут потом раздвинуться за счет термического расширения (вызванного суточными флуктуациями температуры), расширения воды в процессе замерзания, а также воздействия корней растений. Другие физические процессы, например ледниковая деятельность, оползни и истирание песком, производят дальнейшее ослабление и разрушение твердой породы. Эти процессы важны, поскольку они значительно увеличивают поверхностные участки породы, подверженные действию агентов химического выветривания, например воздуха и воды.
Химическое выветривание вызывается водой - особенно кислой водой - и газами, например кислородом, который разрушает минералы. Некоторые ионы и соединения исходного минерала удаляются с раствором, просачивающимся через обломки минералов и питающим грунтовые воды и реки. Тонкозернистые твердые вещества могут вымываться из выветриваемого участка, оставляя химически измененные остатки, которые формируют основу почв. Известны различные механизмы химического выветривания:
1. Растворение. Простейшая реакция выветривания — это растворение минералов. Молекула воды эффективна при разрыве ионных связей, например таких, которые соединяют ионы натрия (Na+) и хлора (Cl-) в галите (каменная соль). Мы можем выразить растворение галита упрощенно, т.е.
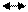 NaCl(тв) Na+(водн) + Cl-(водн)
NaCl(тв) Na+(водн) + Cl-(водн)
2. Окисление. Свободный кислород играет большую роль при разложении веществ в восстановленной форме[32]. Например, окисление восстановленного железа (Fe2+) и сера (S) в обычном сульфиде, пирите (FeS2) приводит к образованию сильной серной кислоты (H2SO4):
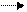 2FeS2(тв) + 7, 5 О2(г) + 7Н2О(ж) 2Fe(OH)3(тв) + Н2SO4(водн).
2FeS2(тв) + 7, 5 О2(г) + 7Н2О(ж) 2Fe(OH)3(тв) + Н2SO4(водн).
Сульфиды часто встречаются в алеврито-глииистых породах, рудных жилах и угольных отложениях. При разработке рудных и угольных месторождений сульфид остается в отработанной породе, которая накапливается в отвалах. Такие отвалы пустой породы имеют большие поверхности, подверженные влиянию атмосферы, где окисление сульфидов происходит быстро и в больших масштабах. Кроме того, заброшенные рудные выработки быстро затопляются грунтовыми водами. Образование серной кислоты делает дренажные воды с заброшенных рудников сильно кислыми (рН до 1 или 2). Такая кислотность может увеличить растворимость алюминия и стать причиной токсичности для водных, экосистем. В окисление сульфидов вовлечены микроорганизмы, что можно моделировать рядом реакций:
 2FeS2(тв) + 7О2(г) + 2Н2О(ж) 2Fe2++ 4Н+(водн) + 4SO42-(водн) (окисление пирита), затем следует окисление железа [Fе(II)] в [Fе(III)]:
2FeS2(тв) + 7О2(г) + 2Н2О(ж) 2Fe2++ 4Н+(водн) + 4SO42-(водн) (окисление пирита), затем следует окисление железа [Fе(II)] в [Fе(III)]:
 2Fe2++ О2(г) + 10Н2О(ж) 4Fe(OH)3(тв) + 8Н+(водн)
2Fe2++ О2(г) + 10Н2О(ж) 4Fe(OH)3(тв) + 8Н+(водн)
Окисление - происходит очень медленно при низких значениях рН кислых рудниковых вод. Однако ниже рН 4, 5 окисление железа катализируют Thiobacillus ferrooxidans и Leptospirillum[33]. Окисное железо может далее взаимодействовать с пиритом:
 FeS2(тв) + 14 Fe3+(водн) + 8Н2О(ж) 15 Fe2+(водн) + 2SO42-(водн) + 16Н+(водн)
FeS2(тв) + 14 Fe3+(водн) + 8Н2О(ж) 15 Fe2+(водн) + 2SO42-(водн) + 16Н+(водн)
При значениях рН намного выше 3 железо (III) осаждается как обычный оксид железа (III), гетит (FеООН):
 Fe3+(водн) + 2Н2О(ж) FеООН + 3Н+(водн)
Fe3+(водн) + 2Н2О(ж) FеООН + 3Н+(водн)
Осажденный гетит покрывает дно ручьев и кирпичную кладку в виде характерного желто-оранжевого налета.
Восстановленные железосодержащие силикаты, например некоторые оливины, пироксены и амфиболы, также могут претерпевать окисление:
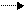 Fe2SiO4(тв) + 1/2O2(г)+ 5H2O(ж) 2Fe(OH)3(тв) + H4SiO4(водн)
Fe2SiO4(тв) + 1/2O2(г)+ 5H2O(ж) 2Fe(OH)3(тв) + H4SiO4(водн)
Продуктами являются кремниевая кислота (H4SiO4) и коллоидный гидроксид железа [Fe(OH)3], слабое основание, которое при дегидратации дает ряд оксидов железа, например Fе2O3 (гематит — темно-красного цвета), FеООН (гетит и лепидокрокит — желтого цвета или цвета ржавчины). Частая встречаемость этих оксидов железа говорит об их нерастворимости в окислительных условиях земной поверхности.
Присутствие воды ускоряет окислительные реакции, о чем свидетельствует ежедневно наблюдаемое явление окисления металлического железа (ржавчина). Вода действует как катализатор, окислительный-потенциал зависит от парциального давления газообразного кислорода и кислотности раствора. При рН 7 вода в контакте с воздухом имеет Еh порядка 810 мВ — окислительный потенциал, намного больший того, который необходим для окисления закисного железа.
Окисление органического вещества. Окисление восстановленного органического вещества в почвах катализируется микроорганизмами. Опосредованное бактериями окисление мертвого органического вещества до СО2 важно с точки зрения образования кислотности. В биологически активных почвах концентрация СО2 может в 10—100 раз превышать ожидаемую при равновесии с атмосферным СО2 приводя к образованию угольной кислоты (Н2СО3) и Н+ при ее диссоциации. Чтобы упростить уравнения, органическое вещество представлено обобщенной формулой для углевода, СН2О:
 СН2О(тв) + О2(г) СО2(г) + Н2О(ж)
СН2О(тв) + О2(г) СО2(г) + Н2О(ж)
 СО2(г) + Н2О(ж) Н2СО3(водн)
СО2(г) + Н2О(ж) Н2СО3(водн)
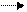 Н2СО3(водн) Н+(водн) + НСО3-(водн)
Н2СО3(водн) Н+(водн) + НСО3-(водн)
Эти реакции могут понизить водный рН почв от 5, 6(значение, которое устанавливается при равновесии с атмосферным СО2) до 4— 5. Это является упрощением, поскольку органическое вещество почв (гумус) не всегда полностью разлагается до СО2. Однако продукты частичного разрушения обладают карбоксильными (СООН) и фенольными группами, которые при диссоциации дают ионы Н+:
 RCOOH(водн) RCOO- (водн) + Н+(водн)
RCOOH(водн) RCOO- (водн) + Н+(водн)
где R означает большую органическую структурную единицу. Кислотность, накапливаемая при разложении органического вещества, используется при разрушении большинства силикатов в процессе кислотного гидролиза.
3. Кислотный гидролиз. Природные воды содержат растворимые вещества, которые придают им кислотность - это и диссоциации атмосферного СО2 в дождевой воде, и частично диссоциация почвенного СО2 с образованием Н2СО3, диссоциация природного и антропогенного диоксида серы (SO2) с образованием Н2SO3 и Н2SО4. Реакцию между минералом и кислыми агентами выветривания обычно называют кислотным гидролизом. Выветривание СаСО3 демонстрирует следующая реакция:
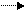 СаСО3(тв) + Н2СО3(водн) Са2+(водн) + 2НСО3-(водн)
СаСО3(тв) + Н2СО3(водн) Са2+(водн) + 2НСО3-(водн)
Кислотный гидролиз простого силиката, например богатого магнием оливина, форстерита, можно обобщить следующим образом:
 Mg2SiO4 (тв) + 4H2CO3(водн) 2Mg2+(водн) + 4НСО3-(водн)+ H4SiO4(водн)
Mg2SiO4 (тв) + 4H2CO3(водн) 2Mg2+(водн) + 4НСО3-(водн)+ H4SiO4(водн)
Отметим, что при диссоциации Н2СО3 образуется ионизированный НСО3-, немного более сильная кислота, чем нейтральная молекула (Н4SiO4), образующаяся при разложении силиката.
4. Выветривание сложных силикатов. До сих пор мы рассматривали выветривание мономерных силикатов (например, оливина), которые полностью растворяются (конгруэнтное растворение). Это упрощало химические реакции. Однако присутствие измененных в процессе выветривания минеральных остатков предполагает, что более распространено неполное растворение. Упрощенная реакция выветривания на примере богатого кальцием анортита:
 CaAl2Si2O8(тв)+2H2CO3(водн)+H2O(ж) Ca2+(водн)+2HCO3-(водн)+ Аl2Si2O5(OH)4(тв)
CaAl2Si2O8(тв)+2H2CO3(водн)+H2O(ж) Ca2+(водн)+2HCO3-(водн)+ Аl2Si2O5(OH)4(тв)
Твердым продуктом реакции является каолинит Аl2Si2O5(OH)4, важный представитель глинистых минералов.
|
|