
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Неметаллы
|
|
1. С какими неметаллами хлор не образует хлоридов? а) S; б) Р; в) О; г) F.
2. Низшая степень окисления хлора равна: а) –7; б) +7; в) +5;
г) –1.
3. Какие галогены в сложных соединениях могут проявлять только отрицательную степень окисления? а) фтор; б) хлор;
в) бром; г) йод.
4. Какие галогены в окислительно-восстановительных реакциях всегда выступают только в роли окислителя? а) фтор; б) хлор; в) бром; г) йод.
5. Какие соединения хлора в ОВР могут выступать только в роли окислителя? а) Сl2O7; б) HCl; в) Cl2; г) HСlO4.
6. Высшая степень окисления хлора равна: а) 7; б) +7; в) +5;
г) –1.
7. Растворы каких солей не могут реагировать с Cl2? а) калий-фторида; б) калий-хлорида; в) калий-бромида; г) калий-иодида.
8. Какие простые вещества при обычных условиях находятся в газообразном состоянии? а) F2; б) Сl2; в) Br2; г) I2.
9. С какими элементами кислород образует оксиды? а) S; б) Ca; в) F; г) Cl.
10. В каких соединениях, из перечисленных ниже, атомы серы или кислорода проявляют валентность, равную 2? а) Н2S;
б) СO; в) S8; г) H2O2.
11. В каких соединениях кислород проявляет степень окисления
«-2»? а) Н2О2; б) Cl2O; в) F2O; г) К2О2.
12. Какие реакции используются для лабораторного получения кислорода?
а) KMnO4  ; б) AgNO3
; б) AgNO3  ; в) Na2SO3
; в) Na2SO3  ; г) Н2О2
; г) Н2О2  .
.
13. С кислородом могут реагировать: а) сера(IV)-оксид; б) кремний(IV)-оксид; в) цинк-сульфид; г) кальций-оксид.
14. Озон является: а) гомологом кислорода; б) изотопом кислорода; в) аллотропной модификацией кислорода; г) изомером кислорода.
15. Какие реакции используются для лабораторного получения кислорода?
а) NaNO3 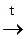 ; б) KClO3
; б) KClO3  ; в) HCl + MnO2
; в) HCl + MnO2 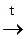 ; г) СаСО3
; г) СаСО3 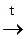 .
.
16. Кислород реагирует с: а) Zn; б) SO3; в) Na; г) NH3.
17. Чему равна степень окисления серы в пирите – FeS2? а) 2;
б) -2; в) -1; г) 0.
18. С какими металлами сера не реагирует? а) Аu; б) Al; в) Hg; г) Pt.
19. В каких реакциях сера выступает в роли восстановителя?
а) S + HNO3 ®; б) S + Na ®; в) S + Cl2 ®; г) S + H2 ®.
20. В каких молекулах сера проявляет промежуточную степень окисления? а) S8; б) H2S; в) SCl4; г) CS2.
21. В каких соединениях атомы серы находятся в своей низшей степени окисления? а) S8; б) SO2; в) K2S; г) NaHSO3.
22. В каких веществах сера может проявлять окислительно-восстановительную двойственность? а) оксид серы (VI);
б) сульфит калия; в) сероводород; г) пластическая сера.
23. Атомы серы проявляют степень окисления +4 в: а) К2SO4;
б) NaHSO3; в) KHS; г) SO2.
24. При взаимодействии с какими веществами сера выступает в роли окислителя? а) Mg; б) О2; в) P; г) Si.
25. При взаимодействии серы с металлами образуются: а) сульфиты; б) гидросульфиды; в) сульфаты; г) сульфиды.
26. Степень окисления –3 азот проявляет в: а) магний-нитриде;
б) магний-нитрате; в) магний-нитрите; г) аммоний-хлориде.
27. В каких реакциях N2 выступает в роли окислителя?
а) N2 + O2 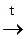 ; б) N2 + H2
; б) N2 + H2 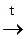 ; в) N2 + Si
; в) N2 + Si 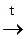 ; г) N2 + Li ®.
; г) N2 + Li ®.
28. Степень окисления +3 азот проявляет в: а) натрий-нитриде;
б) аммиаке; в) кальций-нитрите; г) азотистой кислоте.
29. В каких соединениях азот проявляет минимальную степень окисления? а) Са3N2; б) N2O3; в) N2; г) (NH4)2SO4.
30. Какая высшая степень окисления азота? а) +1; б) +3; в) +4;
г) +5.
31. В каких веществах валентность азота равна трем? а) NH4CI;
б) N2; в) HNO3; г) NH3.
32. В каких веществах азот проявляет низшую степень окисления? а) Si3N4; б) Cl3N; в) NF3; г) Li3N.
33. Азот образуется в результате реакции разложения: а) NaNО3; б) NН4NO2; в) NH4NO3; г) NH4Cl.
34. Какие соединения являются нитридами? а) KNO2; б) Ca3N2;
в) Ba(NO3)2; г) Li3N.
35. Тройная связь в молекуле N2 cостоит из: а) трех s-связей;
б) трех p-связей; в) двух s-связей и одной p-связи; г) одной s-связи и двух p-связей.
36. Какие реакции являются окислительно-восстановительными? а) Р + О2 ®; б) К3Р + Н2О ®; в) Р2О5 + СаО ®; г) P + Cl2 ®.
37. В каких соединениях степень окисления фосфора максимальная? а) Н3РО3; б) Са(Н2РО4)2; в) Са3Р2; г) СаНРО4.
38. Фосфор выступает восстановителем, реагируя с: а) Na;
б) KClO3; в) S; г) HNO3.
39. В каких соединениях степень окисления фосфора минимальна? а) Ca3P2; б) Р2О5; в) Н3РО4; г) PCl3.
40. В каких веществах фосфор проявляет промежуточную степень окисления? а) Na3P; б) H4P2O7; в) H3PO3; г) P4.
41. В каких соединениях фосфор может выступать только в роли окислителя? а) РН3; б) Са3Р2; в) Н3РО4; г) PCl5.
42. В каких реакциях Р выступает в роли окислителя? а) Р + Na ®; б) P + Cl2 ®; в) P + HNO3 ®; г) Р + S ®.
43. В каких веществах валентность фосфора равна трем? а) PCl3; б) H3PO4; в) РH3; г) P4.
44. Высшая степень окисления фосфора равна: а) +4; б) +6; в) +5; г) +7.
45. Фосфор может быть получен по реакции: а) Са3(РО4)2 + СаSiO3 + СO2 ®; б) Са3Р2 + Н2О ®; в) Са3(РО4)2 + SiO2 + C ®; г) Са3(РО4)2 + H2SO4 (конц)®.
46. В роли окислителя углерод выступает при взаимодействии с: а) О2; б) Si; в) HNO3; г) Н2.
47. В каких соединениях углерод проявляет высшую степень окисления? а) алюминий-карбид; б) углерод(IV)-оксид;
в) натрий-карбонат; г) пропан.
48. В каких реакциях углерод проявляет окислительные свойства? а) C + Са®; б) С + FeО®; в) С + Н2®; г) С + Н2О®.
49. В каких соединениях степень окисления углерода не равна «+4»? а) СО; б) SiC; в) CO2; г) СаС2.
50. Какая валентность углерода в углерод(II)-оксиде? а) 1; б) 3;
в) 2; г) +3.
51. В роли восстановителя углерод выступает при взаимодействии с: а) FeО; б) Ca; в) O2; г) Н2.
52. Низшая степень окисления атомов углерода в соединениях равна: а) -2; б) -3; в) -4; г) -5.
53. Какие соединения из перечисленных ниже не являются карбидами? а) Са(НСО3)2; б) Аl4С3; в) K2CO3; г) CS2.
54. В результате взаимодействия углерода с оксидом кальция образуется: а) кальций-карбонат; б) кальций-гидрокарбонат;
в) кальций-карбид; г) кальций-сульфид.
55. В каких соединениях Si проявляет свою низшую степень окисления? а) карборунд; б) кремний(IV)-оксид; в) магний-силицид; г) кремний(II)-оксид.
56. В результате протекания каких реакций образуется силан?
а) SiO2 + NaOH ®; б) SiO2 + H2O®; в) Ca2Si + Н2О®; г) SiO2 + HF®.
57. Высшая степень окисления кремния в соединениях равна:
а) +2; б) +4; в) +5; г) +6.
58. Формула карборунда: а) Si3N4; б) SiC; в) Mg2Si; г) SiCl4.
59. Кремний в промышленности получают по реакции:
а) Na4Si + H2O®; б) SiCl4+ Zn 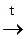 ; в) SiO2 + Mg®; г) Na2SiO3
; в) SiO2 + Mg®; г) Na2SiO3 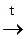 .
.
60. Кристаллическая решетка кремния: а) ионная; б) молекулярная; в) атомная; г) металлическая.
61. В каких реакциях Н2 выступает в роли окислителя?
а) 3Н2 + N2®; б) Н2 + Cl2 ®; в) Н2 + 2Na ®; г) Н2 + С®.
62. Укажите реакции, в которых водород выступает в роли восстановителя: а) S + H2 ®; б) CuO + H2 ®; в) СO + Н2 ®;
г) Ca + H2 ®.
63. При взаимодействии с какими веществами водород выступает в роли окислителя? а) S; б) C2Н2; в) К; г) FeO.
64. При протекании каких химических реакций выделяется водород?
а) Cu + H2SO4(конц.) ®; б) Mg + HNO3(разб.) ®;
в) Mg + H2O  ; г) Mg + H2SO4(разб.) ®.
; г) Mg + H2SO4(разб.) ®.
65. Водород в лаборатории можно получить, используя реакцию:
а) Zn + Н2SО4(конц.) ®; б) Zn + HCl ®; в) Al + KOH + H2O ®;
г) Zn + НNO3(разб.) ®.
66. Какие элементы не проявляют высшей валентности, равной номеру группы? а) Cl; б) С; в) O; г) N.
67. Атомы каких элементов проявляют постоянную степень окисления в сложных веществах? а) F; б) С; в) О; г) Н.
68. Переменную валентность проявляют: а) О; б) Н; в) Сl; г) Р.
69. Какие элементы не имеют аллотропных модификаций? а) сера; б) азот; в) фосфор; г) хлор.
70. Какие простые вещества при обычных условиях не находятся в твердом состоянии? а) О3; б) S8; в) I2; г) Br2.
71. Какие неметаллы встречаются в природе и в свободном, и в связаном виде? а) фтор; б) углерод; в) азот; г) кислород.
72. Какие пары веществ являются аллотропными модификациями? а) кислород, озон; б) этен, этин; в) хлор, фтор; г) графит, алмаз.
73. Высшую степень окисления фосфор проявляет в: а) фосфидах; б) фосфатах; в) гидрофосфатах; г) дигидрофосфатах.
74. Какие из указанных веществ имеют немолекулярное строение? а) графит; б) карборунд; в) кремний; г) озон.
75. Какое водородное соединение элементов IVА группы является наиболее устойчивым? а) СН4; б) SiН4; в) GeН4; г) SnН4.
76. Молекула ромбической серы образована нуклидом 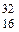 S. Общее число элементарных частиц (протонов, нейтронов и электронов) в ней равно: а) 48; б) 96; в) 192; г) 384.
S. Общее число элементарных частиц (протонов, нейтронов и электронов) в ней равно: а) 48; б) 96; в) 192; г) 384.
77. Общее число элементарных частиц (протонов, электронов, нейтронов) в молекуле белого фосфора равно 184. Каким нуклидом образована эта молекула? а) 30Р; б) 31Р; в) 32Р; г) 29Р.
78. Некоторые ионы вида Э2- химическим количеством 0, 25 моль содержат 2, 709× 1024 электронов. Укажите формулу иона: а) О 2-; б) S 2-; в) Se 2-; г) Те 2-.
79. В порциях каких веществ содержится одинаковое число молекул? а) 99, 2 г белого фосфора; б) 204, 8 г ромбической серы; в) 17, 92 дм3 озона (н.у.); г) 101, 6 г иода.
80. В навесках каких вешеств содержится одинаковое число атомов? а) 74, 4 г белого фосфора; б) 76, 8 г моноклинной серы;
в) 28, 8 г графита; г) 36, 4 г азота.
81. Какой оксид при растворении в Н2О может образовать две кислоты? а) Cl2O; б) NO2; в) Р2О5; г) СO2.
82. Разложение каких солей аммония используют в лаборатории для получения азота? а) NH4NO3; б) NH4NO2; в) (NH4)2Cr2O7;
г) (NH4)2СО3.
83. В каком ряду во всех веществах атомы углерода проявляют валентность «4»?
а) карборунд, алмаз, метан;
б) угарный газ, углекислый газ, карбин;
в) ацетилен, этан, сероуглерод;
г) угольная кислота, муравьиная кислота, формальдегид.
84. В веществах какого ряда валентность и степень окисления атомов углерода численно совпадают?
а) алмаз, графит, карбин;
б) карборунд, сероуглерод, четыреххлористый углерод;
в) метан, ацетилен, этан;
г) угольная кислота, угарный газ, хлорметан.
85. При взаимодействии со всеми веществами какого ряда графит выступает в роли восстановителя?
а) Н2SO4 конц., НNO3 конц., Н2О;
б) S8, CO2, FeO;
в) Н2, N2, Na;
г) О3, Si, Al.
86. Укажите схемы реакций замещения:
а) СО2 + С  ; в) С + H2SO4 конц. ®;
; в) С + H2SO4 конц. ®;
б) СО2 + Mg  ; г) С + Н2О
; г) С + Н2О  .
.
87. Соединения какого ряда получают не взаимодействием между собой соответствующих простых веществ, а косвенным путем?
а) азот(V)-оксид, фосфин, четыреххлористый углерод;
б) азот(I)-оксид, силан, ацетилен;
в) метан, карборунд, сероуглерод;
г) азот(II)-оксид, кальций-карбид, натрий-гидрид.
88. При взаимодействии со всеми веществами какого ряда сера выступает в роли окислителя?
а) HNO3 конц., Cl2, О3;
б) Р4, графит, кремний;
в) NaOH(р-р), Сu, F2;
г) HNO3 (разб.), Н2, О2.
89. В каком ряду все вещества являются аллотропными модификациями по отношению друг к другу?
а) этан, этилен, ацетилен;
б) фуллерен, карбин, графит;
в) карборунд, алмаз, карбид;
г) Н2, D2, Т2.
90. В веществах какого ряда атомы углерода проявляют нулевую степень окисления?
а) формальдегид, дихлорметан, 1, 2-дихлорэтен;
б) фуллерен, алмаз, карбин;
в) кальций-карбид, муравьиная кислота, этен;
г) графит, угарный газ, карборунд.
91. Укажите схемы реакций, которые используются для получения Н2 в промышленности:
а) Fe + H2O  ; в) Na + H2O ®;
; в) Na + H2O ®;
б) CH4 + H2O  ; г) Fe + HNO3 (разб.) ®.
; г) Fe + HNO3 (разб.) ®.
92. Укажите схемы реакций, которые используются для получения О2 в лаборатории:
а) СО + Н2О  ; в) CaSO3
; в) CaSO3  ;
;
б) NaNO3  ; г) NH4NO3
; г) NH4NO3  .
.
93. Даны вещества, формулы которых – H2, N2, Cl2, F2, Al, Fe, Na, Ca. Какое число из них при обычных условиях на воздухе хорошо реагирует с О2? а) 3; б) 4; в) 5; г) 6.
94. Даны вещества, названия которых – кремний, алюминий, кальций оксид, ромбическая сера, озон, углекислый газ. Какое число из них при взаимодействии с углеродом может образовать карбид? а) 2; б) 3; в) 4; г) 5.
95. Даны вещества, формулы которых – H2SO4(конц.), HNO3(конц.), NaOH(р-р), P4, Si, Mg, Cl2, O3. Какое число из них при взаимодейстивии с моноклинной серой выступает в роли окислителя? а) 3; б) 4; в) 5; г) 6.
96. Даны вещества, формулы которых – Si, H2, CaO, Na, CO2, H2O, FeO, HNO3. Какое число из них выступает в роли восстановителя при взаимодействии с графитом? а) 3; б) 4; в) 5; г) 6.
97. Даны вещества, формулы которых – О2, N2, C, P4, S8, H2O, C2H4, F2. Какое число из них не взаимодействует с Cl2? а) 2;
б) 4; в) 3; г) 5.
98. В каком ряду все соединения являются хлоридами?
а) Cl2O; ClF; Cl2O7;
б) ClF3; PCl3; Cl3N;
в) PCl5; SCl4; CCl4;
г) CuCl2; SiCl4; AlCl3.
99. Укажите схемы реакций, при протекании которых может получиться сера:
а) Zn + H2SO4 (конц.) ®; в) SO2 + HNO3 (конц.) ®;
б) H2S + O2 (недост.)  ; г) SO2 + H2S ®.
; г) SO2 + H2S ®.
100. Все вещества какого ряда содержат в своем составе атомы, проявляющие валентность, равную «4»?
а) Si, SiC, SiO2;
б) CO2, P4, S8;
в) О3, H3РO4, N2O4;
г) CS2, SCl4, алмаз.
101. При взаимодействии с веществами какого ряда Cl2 может выступать только в роли окислителя?
а) HI, P4, S8;
б) F2, KMnO4, Al;
в) HBr, H2, C2H4;
г) H2O, Na, Si.
102. Даны вещества, формулы которых – CuO, CO, C2H2, Na, C, S8. Какое число из них при взаимодействии с Н2 выступает в роли окислителя? а) 2; б) 3; в) 4; г) 5.
103. Даны вещества, формулы которых – HBr, NaI, FeCl2, C2H2, CO, P4. Какое число из них вступает с Cl2 в реакцию присоединения? а) 2; б) 3; в) 4; г) 5.
104. Укажите схемы химических реакций, в которых углерод(IV)-оксид выступает в роли окислителя:
а) CO2 + Mg  ; в) CO2 + MgO
; в) CO2 + MgO  ;
;
б) CO2 + C  ; г) CO2 + H2O ®.
; г) CO2 + H2O ®.
105. Во всех веществах какого ряда атомы фосфора проявляют валентность, равную трем?
а) белый фосфор, красный фосфор, P4O6;
б) метафосфорная кислота, пирофосфорная кислота, черный фосфор;
в) ортофосфорная кислота, Р4О10, PCl3;
г) фосфин, PCl5, P2S3.
106. В каком ряду простые вещества расположены в порядке возрастания их окислительной способности?
а) F2, Cl2, Br2, I2;
б) I2, Br2, Cl2, F2;
в) H2, C, Cl2, O3;
г) N2, P4, As, Sb.
107. В каком ряду анионы расположены в порядке возрастания их восстановительной способности?
а) F -, Cl -, Br -, I -;
б) I -, Br -, Cl -, F -;
в) О 2-, S 2-, Se 2-, Te 2-;
г) I -, O 2-, Br -, F -.
108. В каком ряду все вещества используются в промышленности для восстановления металлов из их оксидов?
а) N2, O2, F2, I2;
б) Н2, C, Al, CО;
в) СО2, Si, HI, Cl2;
г) КО2, Н2О2, HNO3, MnO2.
109. Вещества какого ряда взаимодействуют с Н2О, образуя один или два газообразных продукта?
а) NaH, Na, Na3P, Na2C2;
б) KO2, BaO, Cl2, Si;
в) СО, С, F2, CH4;
г) Ca2Si, CaC2, Al4C3, Li3N.
110. Сумма коэффициентов перед формулами веществ в уравнении реакции промышленного получения белого фосфора прокаливанием смеси кальций-фосфата с песком и коксом равна: а) 19; б) 28; в) 35; г) 38.
111. Укажите схемы обратимых реакций:
а) Cl2 + H2O ®; в) N2 + O2  ;
;
б) Cl2 + NaOH (р-р) ®; г) P4 + O2  .
.
112. В соединениях какого ряда атомы хлора в ОВР могут проявлять окислительно-восстановительную двойственность?
а) PCl3, Cl2O, PCl5;
б) NaClO3, Cl3N, ClF;
в) HCl, HClO4, SCl2;
г) Cl2, HClO2, ClF3.
113. Для всех элементов VА группы справедливы утверждения:
а) валентность атомов в образуемых ими простых веществах равна 5;
б) минимальная степень окисления атомов в соединениях равна «-3»;
в) образуемые ими простые вещества при н.у. находятся в твердом агрегатном состоянии;
г) образуют аллотропные модификации.
114. Какие утверждения справедливы для молекул аммиака и белого фосфора?
а) это полярные молекулы;
б) атомы азота и фосфора в них проявляют одинаковую валентность;
в) атомы азота и фосфора в них могут быть донорами электронных пар;
г) в ОВР могут выступать как в роли окислителя, так и в роли восстановителя.
115. Какие утверждения справедливы для ромбической серы и карборунда?
а) оба вещества находятся в одинаковом агрегатном состоянии и имеют одинаковый тип кристаллической решетки;
б) в обоих веществах атомы химических элементов имеют одно и то же значение валентности;
в) в обоих веществах атомы связаны друг с другом за счет ковалентных связей, образованных по обменному механизму;
г) оба вещества являются электролитами.
116. Какие утверждения справедливы для молекулы азота, но являются неверными для молекулы белого фосфора?
а) атомы в молекуле связаны между собой за счет ковалентных связей, образованных по обменному механизму;
б) атомы в молекуле образуют между собой кратные связи;
в) в ОВР молекула может проявлять окислительно-восстано-вительную двойственность;
г) все атомы в молекуле лежат в одной плоскости.
117. Какие утверждения справедливы для атомов водорода и атомов галогенов?
а) в соединениях проявляют одинаковую низшую степень окисления;
б) в невозбужденном состоянии образуют одинаковое число ковалентных связей по обменному механизму;
в) в молекулах образуемых ими простых веществ проявляют одинаковую валентность;
г) содержат на внешнем энергетическом уровне одинаковое число электронов.
118. Какие утверждения справедливы для элементов VIА и VIIА групп?
а) их газообразные водородные соединения в водном растворе окрашивают индикатор лакмус в красный цвет;
б) их высшие оксиды являются кислотными и им соответствуют многоосновные кислоты;
в) образуемые ими простые вещества при н. у. могут находиться только в твердом или газообразном состоянии;
г) в природе встречаются только в связанном виде.
119. Какие утверждения справедливы для элементов IVА группы, но являются неверными для элементов VА группы?
а) образуемые элементами малых периодов простые вещества содержат в своем составе атомы, валентность которых равна номеру группы;
б) элементы малых периодов образуют летучие водородные соединения, водные растворы которых не изменяют окраску индикатора лакмуса;
в) все образуемые элементами данной группы оксиды являются кислотными;
г) все элементы в соединениях могут проявлять валентность равную номеру группы.
120. Какие утверждения справедливы для атомов фтора и хлора?
а) в соединениях образуют только одну ковалентную связь по обменному механизму;
б) в образуемых ими простых веществах проявляют одинаковую валентность;
в) содержат одинаковое число электронных орбиталей на внешнем энергетическом уровне;
г) при образовании ковалентной связи по донорно-акцептор-ному механизму не могут выступать в роли акцептора.
121. Какие утверждения справедливы для алмаза и кремния?
а) это простые вещества, имеющие молекулярную кристаллическую решетку;
б) это простые вещества, имеющие атомную кристаллическую решетку, в которой атомы проявляют валентность, равную номеру своей группы в таблице Д.И. Менделеева;
в) это твердые вещества, обладающие хорошей пластичностью и легко подвергающиеся механической обработке;
г) это вещества, в которых образующие их атомы находятся в своей промежуточной степени окисления.
122. В каких химических реакциях атомы элементов VIА группы выступают одновременно и в роли окислителя, и в роли восстановителя?
а) 2Na2O2 + 2CO2 = 2Na2CO3 + O2;
б) 4CaSO3  3CaSO4 + CaS;
3CaSO4 + CaS;
в) 2H2S + SO2  3S + 2H2O;
3S + 2H2O;
г) 6СO2 + 6H2O 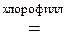 C6H12O6 + 6O2.
C6H12O6 + 6O2.
123. Все элементы какого ряда не образуют аллотропных модификаций?
а) Сl, O, As, Se;
б) Br, N, F, H;
в) S, Te, P, I;
г) C, Si, Sb, Bi.
124. Все соединения какого ряда можно использовать для получения О2 в лаборатории при их термическом разложении?
а) CaSO3, BaSO4, AgNO3;
б) KClO3, KMnO4, Ca(NO3)2;
в) H2O2, NaNO3, KNO3;
г) Na2CO3, K2SO4, Li3PO4.
125. Укажите схемы реакций, при протекании которых может образоваться газ, имеющий плотность по водороду равную 14:
а) CH4 + H2O  ; в) NH4NO2
; в) NH4NO2  ;
;
б) KСlO3 + HCl ®; г) NH4HS + NaOH ®.
126. В каком ряду все соединения содержат атомы Р, находящиеся в своей высшей степени окисления?
а) Ca2P2O7, HPO3, P4O10;
б) H3PO3, Na3P, PCl5;
в) Ca(H2PO4)2, P2S5, CaHPO4;
г) H4P2O7, Na2HPO3, PH4Cl.
127. Определите название вещества, состоящего из атомов натрия, фосфора и кислорода, массовые доли которых в нем составляют, соответственно: 42, 073%, 18, 903% и 39, 024%:
а) натрий-метафосфат; б) натрий-ортофосфат; в) натрий-пирофосфат; г) натрий-фосфид.
128. Какой объем газа выделится при взаимодействии 80 г технического образца карбида кальция, содержащего 8% по массе посторонних примесей, с 50 см3 Н2О (практический выход продуктов в этом процессе составляет 80%)? а) 20, 6 дм3;
б) 25, 78 дм3; в) 28, 72 дм3; г) 32, 14 дм3.
129.Какое число атомов содержится в образце белого фосфора массой 310 г? а) 1, 505 × 1024; б) 3, 01 × 1024; в) 6, 02 × 1024;
г) 9, 01 × 1024.
130. Имеется образец серы массой 16 г, в котором содержится 1, 505 × 1023 молекул. Сколько атомов серы содержится в одной молекуле? а) 2; б) 4; в) 6; г) 8.
131. Какие из перечисленных реакций не осуществимы при предложенных условиях?
а) 4P + 5O2(избыток)  2P2O5; в) C + O2(избыток)
2P2O5; в) C + O2(избыток)  CO2
CO2
б) 2S + 3O2(избыток)  2SO3; г) N2 + 2O2(избыток)
2SO3; г) N2 + 2O2(избыток)  2NO2.
2NO2.
132. В каком ряду все элементы широко встречаются в природе в свободном состоянии?
а) P, B, F, As;
б) N, C, S, O;
в) Si, Cl, Br, Se;
г) H, Ge, I, Sb.
133. В тривиальных названиях веществ какого ряда присутствует слово «известь»?
а) CaCO3, CaSO4 × 2H2O, Na2SO4;
б) NaOH, KСlO, MgSO4 × 7H2O;
в) CaO, Ca(OH)2, CaOCl2;
г) Na2CO3, NaHCO3, Na2CO3 × 10H2O.
134. Аллотропные модификации какого неметалла при обычных условиях могут быть твердыми веществами белого, красного или черного цвета? а) углерода; б) серы; в) фосфора; г) кремния.
135. При сгорании сложного вещества в избытке кислорода образовался неметалл. Им может быть: а) N2; б) Cl2; в) Si; г) H2.
136. Какое простое вещество при обычных условиях хорошо проводит электрический ток? а) алмаз; б) графит; в) моноклинная сера; г) белый фосфор.
137. Какой неметалл свою высшую степень окисления проявляет только в одном веществе? а) кислород; б) хлор; в) азот;
г) фтор.
138. Радиоактивный нуклид какого неметалла используется для определения возраста археологических находок? а) кремния; б) водорода; в) углерода; г) азота.
139. В молекуле какого простого вещества содержится наибольшее число химических связей между атомами? а) белого фосфора; б) ромбической серы; в) озона; г) азота.
140. При получении из фосфата кальция белого фосфора массой 62 г в реакции восстановления затрачивается количество электронов: а) 5 моль; б) 10 моль; в) 15 моль; г) 20 моль.
10. МЕТАЛЛЫ
1. Какие металлы хорошо реагируют с О2 при обычных условиях? а) золото; б) калий; в) алюминий; г) серебро.
2. Какие металлы не являются d-элементами? а) свинец; б) ртуть; в) золото; г) алюминий.
3. Какие металлы реагируют и c НСl, и с H2SO4 (конц.)? а) Zn;
б) Cu; в) Ag; г) Mg.
4. С какими веществами алюминий вступает в реакцию замещения? а) H2SO4 разб.; б) О2; в) Fe2O3; г) Сl2.
5. Какие металлы не реагируют с Н2О даже при нагревании?
а) Mg; б) Ag; в) Fe; г) Hg.
6. С какими веществами при обычных условиях на воздухе не реагирует алюминий? а) водный раствор NaOH; б) вода; в) соляная кислота; г) концентрированная серная кислота.
7. Какие металлы не являются щелочноземельными? а) К; б) Са; в) Hg; г) Ва.
8. С чистой (дистиллированной) водой на воздухе при обычных условиях не реагирует: а) натрий; б) алюминий; в) серебро;
г) кальций.
9. Какие металлы не являются щелочными? а) кальций; б) натрий; в) литий; г) серебро.
10. Какие металлы не реагируют ни с Н2О, ни с НСl? а) железо;
б) медь; в) серебро; г) магний.
11. Какие металлы при обычных условиях хорошо реагируют с Н2О? а) Fe: б) Na; в) Mn; г) Са.
12. Укажите схемы реакций, которые можно использовать для получения железа: а) Fe2O3 + H2®; б) Fe2O3 + Al®;
в) Fe2O3 + СО2®; г) Fe2O3 + Cu®.
13. С водой при обычных условиях хорошо реагирует: а) кальций; б) алюминий-оксид; в) железо; г) кальций-оксид.
14. Какие реакции протекают при обычных условиях?
а) Al + Н2SО4(конц.) ®; б) Al + HCl®; в) Al + H2SO4(разб.) ®;
г) Al + Fe2O3®.
15. Какие металлы являются d-элементами? а) магний; б) железо; в) рубидий; г) цинк.
16. При протекании каких реакций образуется SO2?
а) Cu + H2SO4 (конц.) ®; б) Fe + H2SO4 (разб.) ®;
в) Na2SO3 + HCl ®; г) FeS2 + O2 ®.
17. При нагревании реагируют с Н2О: а) железо; б) медь; в) серебро; г) магний.
18. При протекании каких реакций выделяется водород?
а) Zn + HCl ®; б) Zn + H2SO4(конц.) ®:
в) Zn + H2SO4(разб.)®; г) Zn + НNO3(разб.) ®.
19. Какие кислоты реагируют с медью? а) Н2SO4(конц.);
б) Н2SO4(разб.); в) НNO3(разб.); г) сероводородная кислота.
20. Водород выделится при взаимодействии магния с: а) разбавленной HNO3; б) разбавленной H2SO4; в) Н2О; г) раствором CuCl2.
21. Железо при обычных условиях не реагирует с: а) раствором MgCl2; б) соляной кислотой; в) концентрированной H2SO4;
г) разбавленной HNO3.
22. Какой восстановитель используется в промышленности для получения железа из его оксидов? а) углерод; б) углерод(IV)-оксид; в) углерод(II)-оксид; г) кислород.
23. Какой процесс получения металлов является металлотермией? а) СuO + CO®; б) Al + Fe2O3 ®;
в) WO3 + H2 ®; г) Cr2O3 + Mg®.
24. В результате протекания каких реакций образуется медь(II)-хлорид?
а) Cu + HCl®; б) Cu + ZnCl2®;
в) Cu + Cl2®; г) CuO + HCl®.
25. У щелочных металлов в IА группе сверху вниз увеличивается: а) количество электронов на внешнем слое атома; б) число электронных слоев в атоме; в) величина степени окисления атома; г) атомный радиус.
26. С железо(II)-оксидом реагируют: а) водород; б) углерод(II)-оксид; в) медь(II)-оксид; г) соляная кислота.
27. Самым легкоплавким металлом является: а) железо; б) калий; в) вольфрам; г) ртуть.
28. В результате протекания каких реакций образуется FeCl3?
а) Fe + HCl ®; б) FeO + HCl®;
в) Fe + Cl2 ®; г) Fe(OH)3 + HCl®.
29. В каких реакциях Fe окисляется только до Fe2+?
а) Fe + H2SO4(разб.)®; б) Fe + H2SO4 (конц.)  ;
;
в) Fe + S®; г) Fe + HCl®.
30. Щелочные металлы в промышленности получают из хлоридов: а) электролизом растворов солей; б) электролизом расплавов солей; в) восстановлением углерод(II)-оксидом; г) восстановлением водородом.
31. Алюминий в промышленности получают электролизом: а) раствора AlCl3; б) расплава AlCl3; в) расплава Al2O3; г) раствора Al(NO3)3.
32. Кальций можно получить электролизом: а) растворов его бескислородных солей; б) расплавов его бескислородных солей; в) расплава его оксида; г) раствора его гидроксида.
33. Формула гашеной извести: а) CaO; б) NaOH; в) Са(ОН)2;
г) CaSO4.
34. С азотом при обычных условиях реагирует: а) литий; б) кальций; в) магний; г) алюминий.
35. Атомы металлов в химических реакциях с неметаллами:
а) выступают только в роли окислителя;
б) выступают только в роли восстановителя;
в) проявляют окислительно-восстановительную двойственность;
г) не проявляют окислительно-восстановительных свойств.
36. В каком ряду все представленные металлы являются р-элементами?
а) Fe, Zn, Cu, Fr; б) Al, Pb, Sn, Bi;
в) Ca, Be, Mg, Zn; г) Li, Pt, U, Pu.
37.В каком ряду расположены только щелочноземельные металлы?
а) Be, Mg, Zn, Hg; б) Ca, Ba, Cu, Na;
в) Ca, Ra, Sr, Ba; г) Be, Mg, Sr, Ra.
38. При взаимодействии щелочного металла массой 68 г с концентрированной H2SO4 выделилось 2, 24 дм3 газа, относительная плотность которого по азоту равна 1, 214. Этот щелочной металл: а) Li; б) Na; в) K; г) Rb.
39. В каком ряду все металлы не реагируют с Н2О при обычных условиях?
а) Al, Mg, Be, Ca; б) Fe, Cu, Li, Zn;
в) Ag, Hg, Sn, Pb; г) Li, Na, K, Sr.
40.При взаимодействии всех металлов какого ряда (каждого химическим количеством 0, 75 моль) с избытком раствора серной кислоты выделяется 16, 8 дм3 газа?
а) Be, Cu, Hg, Co; б) Fe, Cr, Zn, Mg;
в) Pb, Li, Ni, K; г) Hg, Ag, Co, Sn.
41. В каком ряду расположены только цветные металлы?
а) Mg, Al, K, Be; б) Fe, Co, Ni, Cr;
в) Au, Ag, Pt, Pb; г) Ca, Ba, Zn, Cu.
42. В каком ряду все металлы являются редкими?
а) La, Ce, Pr, Gd; б) Ag, W, Re, Os;
в) Zn, Fe, Na, Li; г) Bi, Pb, Sn, Al.
43.Радиус частиц последовательно возрастает в ряду:
а) Na+, Ne, Na; б) Na, Ne, Na+;
в) Fe3+, Fe2+, Fe; г) Fe, Fe2+, Fe3+.
44.В образце железа массой 11, 2 г содержится электронов:
а) 11, 2× 1023; б) 26, 204× 1023; в) 31, 304× 1023; г) 67, 424× 1023.
45.Даны вещества, формулы которых – Н2О, Al2O3, H2SO4(конц.), HI(р-р), HNO3(разб.), HBr(р-р). Какое число из них при обычных условиях реагирует с Fe? а) 2; б) 3; в) 4; г) 5.
46.В каком ряду металлы расположены по возрастанию их восстановительной активности в реакциях, протекающих в водной среде?
а) Ag, Fe, Li, Na; б) Zn, Al, Mg, K;
в) Na, Zn, Fe, Cu; г) Na, Ca, K, Li.
47.В каком ряду ионы металлов расположены по возрастанию их окислительной активности в реакциях, протекающих в водной среде?
а) Li+, K+, Ca2+, Mg2+; б) K+, Cu2+, Ag+, Au3+;
в) Hg2+, Ag+, Cu2+, Fe2+; г) Mg2+, Pb2+, Al3+, Cr3+.
48.По отношению к растворам каких солей Mg будет выступать в роли восстановителя в случае протекания между ними реакции? а) K2SO4; б) FeSO4; в) CuSO4; г) Na2SO4.
49.По отношению к каким металлам ионы Cu2+ в водном растворе будут выступать в роли окислителя? а) Ag; б) Pt; в) Pb; г) Fe.
50.Соответственно: первое, второе и третье места (в массовых %) по распространенности в земной коре занимают металлы, расположенные в ряду:
а) Na, K, Li; б) Ca, Fe, K;
в) Ag, Au, Fe; г) Al, Fe, Ca.
51.В каком ряду все металлы в природе встречаются как в свободном, так и в связанном виде (в виде соединений)?
а) K, Li, Mg, Fe; б) Zn, Al, Pb, Sn;
в) Cu, Au, Ag, Pt; г) Ba, Ca, Be, Na.
52.В состав какого природного минерала входят два различных металла? а) малахита; б) криолита; в) доломита; г) сильвинита.
53.В состав какого природного минерала входит только один металл? а) мрамора; б) апатита; в) магнетита; г) халькопирита.
54.В качестве восстановителей в пирометаллургии могут быть использованы все вещества следующего ряда:
а) O2, CO2, Si, B; б) Al, H2, C, CO;
в) CH4, F2, KMnO4, Na; г) Au, Cl2, H2S, NH3.
55.В каком ряду все оксиды металлов являются амфотерными?
а) K2O, CoO, CuO, Ag2O; б) Al2O3, Fe2O3, ZnO, BeO;
в) MnO2, PbO2, PbO, SnO; г) CaO, MgO, HgO, NiO.
56.Между какими парами веществ возможна химическая реакция в водном растворе?
а) Cu + H2SO4 →; б) Cu + HNO3 →;
в) Cu + AgNO3 →; г) Cu + Mg(NO3)2 →.
57.Какие химические реакции используются в гидрометаллургии?
а) 2Na[Au(CN)2] + Zn®Na2[Zn(CN)4] + 2Au;
б) Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3;
в) H2 + Ag2O → 2Ag + Н2О;
г) Fe + CuSO4 = Cu + FeSO4.
58.Известковой водой называется: а) насыщенный раствор Са(ОН)2; б) водная взвесь гашеной извести; в) водная взвесь кальций-карбоната; г) насыщенный раствор кальций-гидрокарбоната.
59.Известковым молоком называется: а) водная взвесь негашеной извести; б) водный раствор гашеной извести; в) водная взвесь гашеной извести; г) расплав негашеной извести.
60.Какой объем (см3) занимает образец железа, содержащий 2, 709× 1023 атомов и имеющий плотность 7, 87 г/см3? а) 3, 2;
б) 4, 65; в) 4, 87; г) 5, 12.
61.Какая максимальная масса NaOH, находящегося в водном растворе, может прореагировать с 25, 5 г Al2O3? а) 20 г; б) 35, 4 г;
в) 54, 8 г; г) 60 г.
62.В тривиальных названиях всех веществ какого ряда присутствует слово «сода»? а) CaSO4, CaSO4× 2H2O, Ca(HSO4)2;
б) Na2CO3, NaHCO3, Na2CO3 × 10H2O; в) K2CO3, KCl, KNO3;
г) Ca3(PO4)2, Ca(H2PO4)2, CaHPO4.
63.Какова последовательность восстановления оксидов железа при промышленном получении этого металла в домнах из бурого железняка?
а) FeO® Fe3O4 ®Fe2O3 ®Fe;
б) Fe2O3 ®FeO ®Fe3O4 ®Fe;
в) Fe2O3 ®Fe3O4 ®FeO ®Fe;
г) Fe3O4 ®Fe2O3 ®FeO ®Fe.
64.Чугун – это:
а) техническое название химически чистого железа;
б) сплав железа с углеродом, в котором массовая доля углерода колеблется в интервале 2-4%;
в) сплав железа с углеродом, в котором массовая доля углерода колеблется в интервале 0, 3-1, 9%;
г) исходное сырье для получения стали в промышленности.
65.Даны вещества, формулы которых: Na2O2, H2O, H2, Cl2, CuO, HNO3 (конц.). Число веществ, с которыми металл натрий вступает в реакцию присоединения, равно: а) 2; б) 3; в) 4; г) 5.
66.Даны вещества, формулы которых: H2O, ZnCl2, FeCl2, AgNO3, CO, HCl(р-р). Число веществ, с которыми металл железо вступает в реакцию замещения, равно: а) 2; б) 3; в) 4; г) 5.
67.В какой частице содержится столько же электронов, как и в формульной единице кальций-гидроксида? а) Sr0; б) Zr2+;
в) Br-; г) Nb3+.
68.Массовая доля СаО в твердом остатке, полученном при прокаливании образца известняка, содержащего нелетучие и неразложимые примеси, составляет 80%. Массовая доля примесей в образце известняка равна: а) 8, 64%; б) 9, 72%; в)10, 37%;
г) 12, 28%.
69.В растворе натрий-гидроксида объемом 250 см3 содержится 9, 03 × 1022 ионов Na+. Молярная концентрация NaOH в растворе (моль/дм3) равна: а) 0, 15; б) 0, 3; в) 0, 6; г) 0, 85.
70.Укажите число различных характеристик (из перечисленных ниже), которые не совпадают для атома Са и катиона Са2+: массовое число; общее число электронов в частице; восстановительная способность; радиус частицы; число протонов; энергия сродства к электрону: а) 2; б) 3; в) 4; г) 5.
71.При взаимодействии Cu химическим количеством 0, 75 моль с разбавленной азотной кислотой на солеобразование расходуется кислота химическим количеством (моль): а) 0, 75; б) 1, 5;
в) 2, 25; г) 2, 5.
72.В некотором сплаве на 5 атомов золота приходится 2 атома меди. Укажите массовую долю (%) золота в сплаве: а) 58, 5;
б) 75, 8; в) 88, 5; г) 92, 5.
73.Укажите формулу возможного продукта, образующегося при протекании реакции между расплавом алюминий-оксида и стронций-гидроксида:
а) Sr(AlO3)3; в) Sr[Al(OH)4]2;
б) Sr(AlO2)2; г) Al2(SrO2)3.
74.В каком ряду приведены только названия сплавов металлов?
а) доломит, малахит, мельхиор; б) чугун, латунь, дуралюмин; в) бронза, халькопирит, магнетит; г) сталь, флюорит, поташ.
75.В каком ряду все приведенные формулы отражают основной состав различных драгоценных и полудрагоценных камней?
а) Al2O3, SiO2, CuCO3× Cu(OH)2;
б) Na2O × CaO × 6SiO2, CaSO4 × 0, 5H2O, Na3AlF6;
в) CaCO3, Cu2S, Al2O3 × nH2O;
г) 3Ca3(PO4)2 × CaF2, Na2SO4 × 10H2O, HgS.
76.Какая масса железной руды с массовой долей магнетита 65% потребуется для получения чугуна массой 2, 5 т (массовая доля углерода в чугуне составляет 4%, остальные примеси не учитывать)? а) 4, 25 т; б) 5, 1 т; в) 6, 34 т; г) 6, 65 т.
77.В каком ряду все приведенные ионы металлов обладают только окислительными свойствами?
а) Na+, K+, Ag+, Cu+; б) Ca2+, Mg2+, Cr2+, Pb2+;
в) Ba2+, Tl3+, Li+, Al3+; г) Au+, Sr2+, Sn2+, Hg22+.
78.В каком ряду все приведенные ионы металлов обладают окислительно-восстановительной двойственностью?
а) Ag+, Co2+, Ni2+, Zn2+; б) Fe2+, Mn2+, Sn2+, Au+;
в) K+, Rb+, Cs+, Bi3+; г) Al3+, Ra2+, Be2+, Au3+.
79.Какими веществами металлический хром при обычных условиях окисляется до Cr2+? а) H2SO4(конц.); б) HNO3(конц.);
в) НCl; г) H2SO4(разб.).
80.Укажите название природного минерала, из которого можно получить медь: а) мрамор; б) малахит; в) фосфорит;
г) сильвинит.
81.Какие утверждения справедливы для атома Cu и иона Cu2+?
а) обе эти частицы в ОВР могут выступать только в роли восстановителя;
б) обе эти частицы содержат однаковое число протонов;
в) обе эти частицы имеют одинаковый радиус;
г) обе эти частицы, хотя бы частично, не взаимодействуют с Н2О при обычных условиях (процесс гидратации не учитывать).
82.Какие утверждения справедливы для иона Ва2+, но являются неверными для атома Ва?
а) эти частицы не вступают с Н2О в ОВР;
б) в ОВР данные частицы могут выступать только в роли окислителя;
в) общее число электронов в каждой из них равно порядковому номеру элемента бария в таблице Д.И. Менделеева;
г) число протонов в каждой из них равно массовому числу частицы.
83.Какие утверждения являются неверными как для иона Al3+, так и для атома Na?
а) обе эти частицы, образуя ковалентную связь по донорно-акцепторному механизму, выступают в роли донора;
б) обе эти частицы в ОВР могут выступать только в роли восстановителя;
в) обе эти частицы восстанавливаются на катоде при электролизе водного раствора, в котором они находятся;
г) электроны в каждой из этих частиц в невозбужденном состоянии расположены на трех энергетических уровнях.
84.В каком случае при протекании каждой из двух предложенных реакций образуется один и тот же газ?
а) NaH + H2O ®; Na + H2SO4(конц.)®;
б) Al + H2SO4(р-р) ®; Al + NaOH + H2O®;
в) Na + HNO3(конц.)®; Na + NH3t®;
г) AlN + H2O ®; AlN + H2SO4(р-р)®.
85.В каком ряду оксиды металлов расположены в порядке убывания их основных свойств?
а) MnO, Mn2O3, MnO2, Mn2O7; б) Rb2O, K2O, Na2O, Li2O;
в) Fe2O3, FeO, CaO, CuO; г) MgO, CaO, SrO, BaO.
86.При действии на 250 г известняка избытком разбавленной серной кислоты выделилось 44, 8 дм3 газа. Массовая доля примесей в известняке равна: а) 18, 5%; б) 20%; в) 22, 55%; г) 25%.
87.Какие из перечисленных частиц имеют одинаковую электронную формулу: а) Se2-; б) Kr; в) Sr2+; г) Nb3+.
88.В реакции металла массой 18, 4 г с кремнием (избыток) образовался силицид металла массой 24 г. Укажите символ металла: а) Al; б) Mg; в) Ca; г) Na.
89.Металлические свойства атома элемента тем выше:
а) чем больше электронов находится на его внешнем энергетическом уровне;
б) чем меньше его энергия ионизации;
в) чем меньше его радиус;
г) чем больше у него энергетических уровней.
90.Какие из ионов металлов имеют электронную формулу 1s22s22p63s23p6? а) Ga3+; б) Sc3+; в) Ca2+; г) Ti2+.
91.Какой из перечисленных металлов имеет наибольшее значение энергии сродства к электрону? а) Na; б) Rb; в) Ca; г) Al.
92.Какой из перечисленных металлов имеет наименьшее значение энергии ионизации? а) Fe; б) Sr; в) Cd; г) Cs.
93.Восстановительные свойства металла зависят от: а) количества электронов на внешнем энергетическом уровне его атома;
б) количества электронных слоев в его атомах; в) числа имеющихся изотопов; г) его распространения в природе.
94.Какая из предложенных реакций неосуществима в разбавленном водном растворе?
а) 2K + CuCl2 = 2KCl + Cu;
б) Cu + 2HNO3 = Cu(NO3)2 + H2;
в) Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O;
г) 2Al + 3H2SO4 = Al2(SO4)3 + 3H2.
95.Степень окисления железа в соединениях Ca(FeO2)2, K3[Fe(CN)6], K2FeO4 соответственно равна: а) +2, +3, +2;
б) +3, +3, +6; в) +3, +2, +3; г) +3, +2, +2.
96.Какие из предложенных электронных формул принадлежат атомам переходных металлов?
а) 1s22s22p63s23p33d3; б) 1s22s22p63s23p63d34s14p1;
в) 1s22s22p63s23p63d104s2; г) 1s22s22p63s23p63d104s24p1.
97.Соединение железа (III) можно получить в результате реакции:
а) Fe(OH)2 + H2O + O2 ®; б) Fe + H2O  ;
;
в) K3[Fe(OH)6] + HCl (избыток)®; г) Fe + H2SO4(разб.) ®.
98.Соединение железа (II) получается в результате реакции:
а) Fe + H2SO4(конц.)  ; б) Fe + HNO3(разб.)®;
; б) Fe + HNO3(разб.)®;
в) Fe + HNO3(конц.)  ; г) Fe + HI®.
; г) Fe + HI®.
99.Отметьте схемы реакций, в результате которых образуется железо(III)-оксид:
а) Na3[Fe(OH)6] + HCl ®; в) Fe(NO3)3  ;
;
б) Fe(OH)3 + NaOH(тв.)  ; г) FeO + CO
; г) FeO + CO  .
.
100.Отметьте верные утверждения:
а) в четвертом периоде все d-элементы в невозбужденном состоянии содержат на последнем энергетическом уровне одинаковое число электронов;
б) все d-элементы, принадлежащие к одному и тому же периоду, в соединениях проявляют одинаковую степень окисления;
в) все d-элементы являются металлами;
г) все d-элементы в природе встречаются как в свободном состоянии, так и в виде соединений.
101.Отметьте неверные утверждения:
а) металлы принадлежат только к s- и d-элементам;
б) все металлы в природе встречаются только в связанном виде, т.е. в соединениях с другими элементами;
в) металлы являются проводниками первого рода;
г) металлы при взаимодействии с неметаллами не проявляют окислительных свойств.
102.При взаимодействии с разбавленной азотной кислотой серебра химическим количеством 0, 75 моль на окисление расходуется HNO3 химическим количеством (моль): а) 0, 25; б) 0, 75;
в) 2, 25; г) 3.
103.При взаимодействии концентрированной серной кислоты с 0, 25 моль натрия на солеобразование затрачивается H2SO4 химическим количеством (моль): а) 0, 125; б) 0, 5; в) 1, 25; г) 1, 5.
104.Отметьте неверные утверждения:
а) в гидрометаллургии в качестве восстановителя используются соединения неметаллов;
б) простые вещества, образованные металлами, имеют атомную кристаллическую решетку;
в) все металлы обладают схожими физическими свойствами;
г) в пирометаллургии в качестве восстановителей наряду с неметаллами могут использоваться и металлы.
105.Даны вещества, формулы которых – CO2, H2SO4(разб.), Fe2O3, С6Н6, NaCl, CH4. Число веществ, с которыми Al вступает в реакцию замещения, равно: а) 2; б) 3; в) 4; г) 5.
106.Некоторые катионы вида МеОН+ химическим количеством 0, 4 моль содержат 86, 688 × 1023 электронов. Укажите формулу катиона: а) FeOH+; б) NiOH+; в) CuOH+; г) ZnOH+.
107.Некоторые катионы вида Ме (ОН)2+ химическим количеством 0, 5 моль содержат 12, 642 × 1024 протонов. Укажите формулу катиона: а) V(OH)2+; б) Fe(OH)2+; в) Cr(OH)2+; г) Al(OH)2+.
108. Коррозия – это:
а) процесс изменения типа кристаллической решетки металла в ходе его эксплуатации;
б) самопроизвольный процесс восстановления ионов металла, протекающий при повышенной температуре;
в) самопроизвольный процесс окисления металла вследствие его взаимодействия с окружающей средой;
г) изменение восстановительной активности атомов металла, обусловленное его контактом с водной средой.
109. Коррозия бывает: а) механической; б) электрической; в) химической; г) электрохимической.
110. Газовая коррозия обусловлена:
а) взаимодействием металлов с кислородом, растворенным в Н2О;
б) взаимодействием металлов с газами при повышенной температуре в отсутствии Н2О;
в) растворением молекул газа в кристаллической решетке металла;
г) процессом восстановления ионов металла вследствие их контакта с агрессивными газами при повышенной температуре.
111. Электрохимическая коррозия железа протекает быстрее в том случае, если:
а) металл является химически чистым и не содержит посторонних примесей;
б) изделие не вступает в контакт с влагой;
в) металл содержит небольшие примеси хрома;
г) металл содержит небольшие примеси серебра.
112. В качестве анодного покрытия для защиты медного изделия может выступать пленка из: а) цинка; б) магния; в) серебра;
г) золота.
113. Электрохимическая коррозия изделия из меди протекает медленнее в том случае, если оно:
а) вступает в контакт с водной средой;
б) вступает в контакт с жидкостью, не способной проводить электрический ток;
в) вступает в контакт с изделием из золота;
г) вступает в контакт с изделием из железа.
114. В качестве катодного покрытия для защиты железного изделия может выступать пленка из: а) цинка; б) хрома; в) никеля; г) олова.
115. Электрохимическая коррозия – это:
а) процесс самопроизвольного окисления металла вследствие его контакта с водным раствором;
б) процесс самопроизвольного окисления металла вследствие его контакта с неполярной органической жидкостью;
в) процесс самопроизвольного окисления металла вследствие его контакта с влажным воздухом;
г) процесс самопроизвольного окисления металла вследствие его контакта с воздухом, не содержащим водяных паров.
116. При электрохимической защите металлического изделия от коррозии в водной среде его:
а) соединяют проводником с отрицательно заряженным полюсом источника постоянного тока;
б) соединяют проводником с положительно заряженным полюсом источника постоянного тока;
в) соединяют проводником с пластиной из менее активного металла;
г) соединяют проводником с пластиной из более активного металла.
117. Для предохранения металлического изделия от газовой коррозии используется:
а) катодная защита;
б) протекторная защита;
в) нанесение на его поверхность жаростойких прочных неорганических эмалей;
г) нанесение на поверхность изделия пленки из другого металла, обладающей защитным действием.
118. Электрохимическая коррозия изделия из марганца протекает быстрее всего, если оно содержит примеси: а) цинка; б) свинца; в) меди; г) платины.
119. Электрохимическая коррозия изделия из меди протекает медленнее всего, если оно содержит примеси: а) магния; б) железа; в) алюминия; г) свинца.
120. Для гидроксида переходного металла в низшей положительной степени окисления характерны свойства: а) окислительные и кислотные; б) окислительные и основные; в) восстановительные и кислотные; г) восстановительные и основные.
121. Для гидроксида переходного металла в высшей положительной степени окисления характерны свойства: а) окислительные и кислотные; б) окислительные и основные; в) восстановительные и кислотные; г) восстановительные и основные.
122. Укажите суммарное число элементов – металлов, входящих в состав перечисленных веществ: гематит, магнетит, малахит, доломит, флюорит, известняк: а) 3; б) 4; в) 5; г) 6.
123. Соединение какого металла является основным компонентом жемчуга? а) меди; б) алюминия; в) кальция; г) калия.
124. Укажите смесь металлов, при действии на которую избытка соляной кислоты выделится наибольшее количество водорода (массы смесей равны и массовые доли металлов в каждой смеси равны между собой): а) Cu, Fe, Na; б) Mg, Li, Al; в) Hg, Pb, Ca; г) Fe, Zn, Ba.
125. У какого металла в невозбужденном состоянии на внешнем энергетическом уровне находится один электрон? а) железа;
б) меди; в) ртути; г) хрома.
126. Какие из перечисленных металлов могут образовывать как основные, так и амфотерные, и кислотные оксиды? а) алюминий; б) хром; в) медь; г) марганец.
127. На восстановление меди из ее медь(II)-оксида затратили 3, 612∙ 1024 электронов. Масса (в г) образовавшегося при этом металла равна: а) 128; б) 164; в) 192; г) 384.
128. Укажите схемы реакций, при протекании которых происходит процесс восстановления металла:
а) NaН + Н2О →;
б) Сu + Нg(NО3)2 →;
в) WО3 + Н2 →;
г) CuО + СО →.
129. Укажите схему реакции, которая может быть использована в пирометаллургии:
а) Fe + CuSO4 →;
б) Ca + CsCl →;
в) KCl (расплав)  ;
;
г) FeO + Si →.
130. Укажите схемы реакций, при протекании которых происходит процесс окисления металла:
а) FeCl2 + Cl2→;
б) Cr(OH)2 + O2 + H2O→;
в) ZnO +
|
|