
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Методом градуировочной кривой.
|
|
Метод основан на способности ионов Fe3+ образовывать с роданид ионом ряд комплексов, окрашенных в кроваво-красный цвет: Fe3+ 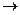 n SCN-
n SCN- 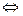 Fe(SCN)n3-n
Fe(SCN)n3-n
Число ионов роданида n может меняться от 1 до 6. В этой работе берется избыток роданид ионов. Примесь двухвалентного железа, имеющегося в растворе, переводят в трехвалентное добавлением персульфата аммония. Для подавления гидролиза солей железа (Ш) создают кислую среду с помощью азотной кислоты. Для стабилизации роданидных комплексов добавляют пероксид водорода, и растворы готовят непосредственно перед колориметрированием, так как окраска растворов неустойчива.
В данном методе анализа используется градуировочная кривая. Эта кривая строится по серии стандартных растворов соли железа. Она выражает зависимость оптической плотности от концентрации.
Ход работы: 1. Приготовление серии стандартных растворов. В мерные колбы на 100 мл помещают, используя градуированную пипетку, последовательно 1, 0; 2, 0; 3, 0; 5, 0; 7, 0; 9, 0; 10, 0; 12, 0 мл исходного раствора железа, довести до метки дистиллированной водой, закрыть пробкой и перемешать опрокидыванием колбы.
В пронумерованные конические колбы взять пипеткой на 20 или 25 мл каждого раствора, прибавить к ним по 1 мл азотной кислоты и по нескольку кристалликов персульфата аммония. Выдержать 10 минут.
Добавить в каждый раствор по 5 мл 10 % раствора роданида аммония и по 2 капли пероксида водорода, перемешать смеси.
Начиная с самого разбавленного, поместить раствор в кювету фотоколориметра и колориметрировать с синим светофильтром (470-500 нм).
Рассчитать концентрацию каждого раствора по формуле: 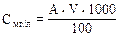 , где
, где
А – концентрация стандартного раствора;
V – объем стандартного раствора.
По полученным значениям оптической плотности и концентрации растворов строят на миллиметровой бумаге калибровочный график зависимости D от С, откладывая по оси абсцисс концентрацию, а по оси ординат - оптическую плотность.
2. Получите контрольный раствор и приготовьте окрашенный раствор по такой же схеме, как и при приготовлении стандартной серии. Измерьте оптическую плотность. Отложите это значение на оси ординат построенного графика. Проведите по линейке параллельную оси абсцисс линию до пересечения с калибровочной прямой, опустите из точки пересечения перпендикуляр на ось абсцисс. Найдите, таким образом, концентрацию контрольного раствора. Если раствор приготовлен самостоятельно, то рассчитайте ошибку определения (%): 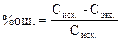
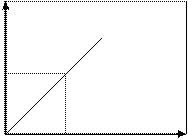 D
D

Сх С, мг/л
Тема. Полимеры
Содержание темы. Структура и классификация полимеров, особенности свойств полимеров, агрегатное, фазовое и физическое состояние полимеров, химические свойства полимеров, деструкция полимеров
Наиболее важные термины: полимеры, мономеры, степень полимеразии, сополимеры, синтетические, искусственные полимеры, гомоцепные и гетероцепные полимеры, термопластичные и термореактивные, гибкость цепи, температура стеклования, высокоэластичное состояние, релаксация, студни, деструкция.
|
|