
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Определение гидрокарбонат-ионов при наличии свободной углекислоты (рН от 4,5 до 8,3)
|
|
Количество гидрокарбонат-ионов определяют также методом нейтрализации. Гидрокарбонаты при этом переходят в хлориды:
Са(HСО3)2 + 2 НС1= СаСl2 + 2 СО2 + 2Н2О или HСО3- +H+ =Н2О+ СО2.
Титрование ведут с индикатором метиловым оранжевым до розово-оранжевой окраски (рН ~ 4, 5).
Ход работы. В коническую колбу емкостью 250-300 мл отмеряют мерным цилиндром 100 мл исследуемой воды и добавляют 2-3 капли раствора индикатора метилового оранжевого. Заполняют бюретку рабочим раствором (раствор соляной кислоты), устанавливают нулевую отметку и титруют 0, 1 н раствором соляной кислоты до розово-оранжевой окраски раствора.
Титрование проводят не менее трех раз, результаты заносят в таблицу, аналогичную табл.1..
Количество гидрокарбонатной углекислоты X2 рассчитывают по формуле:
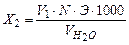 , мг/л,
, мг/л,
где V1 - объем раствора соляной кислоты, израсходованной на титрование, мл;
N - нормальность раствора соляной кислоты, мг-экв/л;
Э - миллиграмм-эквивалент гидрокарбонат-иона (22 мг)в пересчетенасвободную CO2 согласно уравнению;
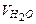 - объем исследуемой воды, мл.
- объем исследуемой воды, мл.
Определение агрессивной двуокиси углерода методом расчета по Леманну и Реуссу
Расчет основан на определении свободной двуокиси углерода, избыточной по отношению к той ее части, которая находится в равновесии с гидрокарбонат-ионами (HCO3-).
Правильность расчета зависит от многих факторов, поэтому результаты его почти всегда являются приближенными.
Расчет. Содержание агрессивной двуокиси углерода по Леманну и Реуссу (в мг/л) вычисляют по формуле: X = g – X2,
где g - величина, найденная по таблице Леманна и Реусса, соответствующая отдельно вычисленной величине S (см. приложение1):
S - сумма свободной и гидрокарбонатной углекислоты;
g - вычисленная сумма гидрокарбонатной и агрессивной углекислоты
X2 - содержание гидрокарбонатной углекислоты (точнее - общая щелочность воды), мг/л.
Вспомогательную величину для пользования таблицей Леманна и Реусса вычисляют по формуле: S = X1 + X2,
где Х1 - количество растворенной углекислоты (точнее общая кислотность воды), мг/л.
Пример. Найдено, что содержание гидрокарбонат-иона
X2 = 100 мг/л, а количество растворенной углекислоты
Х1 = 60 мг/л. Их сумма:
S= 100 + 60 = 160 мг/л.
По таблице Леманна и Реусса этой величине в графе g соответствует цифра 118, 1, представляющая собой сумму гидрокарбонатной и агрессивной углекислоты. Вычитая из этой величины количество гидрокарбонатной углекислоты, получаем количество агрессивной углекислоты:
Х = 118, 1 – 100 = 18, 1 мг/л.
Сделайте вывод по работе и ответьте на вопросы.
Вопросы:
1. Дайте определение коррозии.
2. Виды коррозии металлических конструкций
3. В чем отличие химической коррозии металлов от электрохимической?
4. Виды коррозии бетона
5. Какая среда наиболее губительна для портландцемента?
6. В чем заключается особенность коррозионных процессов ж/б арматуры в бетоне?
7. Методы защиты от коррозии
8. Подберите протектор для защиты изделия из сплава Sn-Pb от коррозии в водном растворе с кислородной деполяризацией; Составьте уравнения процессов коррозии.
9. Медный кабель находится в свинцовой оболочке. Среда – влажный воздух с рН = 7. Что будет корродировать, при нарушении оболочки? Напишите уравнения электродных процессов и суммарной реакции коррозии. Составьте схему коррозионного Г.Э.
10. Можно ли хранить в контакте магний и алюминий во влажной среде с рН = 7? Ответ мотивируйте.
11. Составьте уравнения электродных процессов и суммарной реакции, происходящих при атмосферной коррозии (рН = 7) луженого железа и луженой меди в случае нарушения целостности покрытия.
|
|