
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ЗАНЯТТЯ № 18
|
|
Тема: ЕЛЕКТРОЛІЗ. АКУМУЛЯТОРИ
Мета заняття: навчитися записувати рівняння процесів, що відбуваються на електродах при електролізі водних розчинів та розплавів. Навчитися проводити обчислення з використанням законів Фарадея. Ознайомитися з будовою і роботою кислотних і лужних акумуляторів.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Електроліз розплавів і водних розчинів електролітів.
2. Електроліз з активним та з інертним анодом.
3. Закони Фарадея.
4. Використання процесів електролізу в промисловості і техніці.
5. Який пристрій називається акумулятором? Основні типи акумуляторів та принципи їх роботи.
ТЕОРЕТИЧНІ ВІДОМОСТІ
Електроліз – це окисно-відновний процес, який відбувається за рахунок перетворення електричної енергії в хімічну під час проходження крізь розчин або розплав електроліту постійного електричного струму.
Якщо через розчин або розплав електроліту пропустити електричний струм, то рух іонів стає спрямованим: катіони рухаються до катода, а аніони – до анода. Електрод, на якому відбувається відновлення – катод, під час електролізу заряджений негативно; електрод, на якому відбувається окиснення – анод, заряджений при електролізі позитивно. На катоді першою відновлюється та електрохімічна система, потенціал якої більший, а на аноді першою окиснюється та система, потенціал якої менший.
Для кількісних обчислень використовують закони Фарадея.
І закон Фарадея: маси чи об’єм речовин, що перетворюються на електродах під час електролізу, пропорційні кількості електрики, яка пройшла через електроліт:
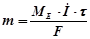 ,
,
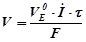 ,
,
де  і
і 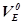 - відповідно еквівалентна маса чи еквівалентний об’єм визначуваної речовини.
- відповідно еквівалентна маса чи еквівалентний об’єм визначуваної речовини.
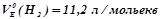 ,
, 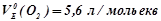 .
.
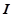 - сила струму, А;
- сила струму, А;
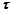 - час електролізу, с;
- час електролізу, с;
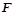 - стала Фарадея;
- стала Фарадея; 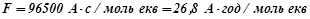 .
.
ІІ закон Фарадея: однакові кількості електрики виділяють при електролізі еквівалентні кількості будь-яких речовин, тому маси речовин, що перетворюються на електродах при проходженні однакової кількості електрики, пропорційні їх еквівалентним масам, а об’єми (за н.у.) – еквівалентним об’ємам:
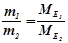 ,
, 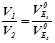 .
.
Вихід за струмом ( ) – це відношення фактично одержаної при електролізі маси речовини (
) – це відношення фактично одержаної при електролізі маси речовини (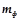 ) до теоретично обчисленої (
) до теоретично обчисленої (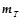 ):
):
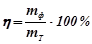 .
.
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
Приклад 1. Які процеси будуть відбуватися при проходженні постійного електричного струму через розчин купрум (ІІ) хлориду?
Розв’язок. Дисоціація солі в розчині:
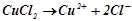 .
.
Отже, у електроліті є іони 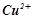 ,
, 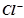 та молекули
та молекули 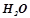 , здатні і окиснюватись і відновлюватись.
, здатні і окиснюватись і відновлюватись.
На катоді можливе відновлення і іонів 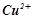 і молекул
і молекул 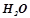 :
:
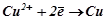 ;
; 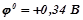 ;
;
 ;
; 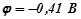 (при рН=7).
(при рН=7).
Потенціал відновлення іонів 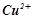 вищий, тому при електролізі водних розчинів солей міді на катоді в першу чергу відновлюється мідь.
вищий, тому при електролізі водних розчинів солей міді на катоді в першу чергу відновлюється мідь.
На аноді першим окиснюється безоксигеновмісний аніон:
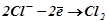 ;
;
Отже, при електролізі водного розчину купрум хлориду з інертними електродами відбуваються процеси:
K:  (відновлення);
(відновлення);
A: 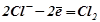 (окиснення).
(окиснення).
Сумарна реакція:
 , або
, або
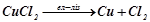 .
.
Як видно з рівняння, продуктами електролізу є мідь і газоподібний хлор.
Приклад 2. Як відбувається електроліз водного розчину калій сульфату? Електроди виготовлені з графіту.
Розв’язок. Дисоціація солі:
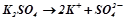 .
.
У електроліті – іони 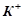 ,
, 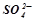 і молекули води.
і молекули води.
На катоді будуть відновлюватись молекули води, бо потенціал цього процесу (-0, 41 В) вищий, ніж потенціал відновлення іонів 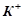 (-2, 92 В).
(-2, 92 В).
На аноді першим відбувається процес окиснення молекул 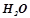 , бо потенціал цього процесу (+1, 23 В) менший, ніж потенціал окиснення оксигеновмісних аніонів, в т.ч. іонна
, бо потенціал цього процесу (+1, 23 В) менший, ніж потенціал окиснення оксигеновмісних аніонів, в т.ч. іонна 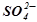 .
.
Отже, при електролізі водного розчину калій сульфату на інертних графітових електродах відбуваються такі процеси:
K: 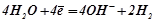 (відновлення);
(відновлення);
A: 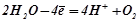 (окиснення).
(окиснення).
Сумарна реакція одержується додаванням почленно обох рівнянь:
 ;
;
скорочено:
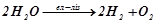 .
.
В цьому випадку електроліт 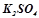 служить лише струмопровідним середовищем, а процес зводиться до електролітичного розкладу води. Продуктами електролізу є водень і кисень.
служить лише струмопровідним середовищем, а процес зводиться до електролітичного розкладу води. Продуктами електролізу є водень і кисень.
Приклад 3. Як відбувається електроліз водного розчину купрум (ІІ) сульфату з мідними електродами?
Розв’язок. Мідний анод – це активний розчинний анод, здатний окиснюватися. Потенціал окиснення міді (+0, 34 В) значно менший від потенціалу окиснення води і сульфат – аніонів, тому першим буде окиснюватись мідний анод.
На катоді – відновлення іонів  , бо їх потенціал (+0, 34 В) більший від потенціалу відновлення води (-0, 41 В).
, бо їх потенціал (+0, 34 В) більший від потенціалу відновлення води (-0, 41 В).
Процеси при електролізі:
Дисоціація солі: 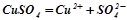 ;
; 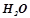 ; Анод -
; Анод - 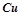 .
.
Процеси на електродах:
K: 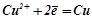 ;
;
A: 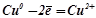 .
.
Отже, в результаті електролізу водного розчину солі 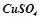 з мідним анодом мідний анод розчиняється, а на катоді осаджується металічна мідь. Цей процес широко використовується в промисловості для очистки міді (електролітичне рафінування).
з мідним анодом мідний анод розчиняється, а на катоді осаджується металічна мідь. Цей процес широко використовується в промисловості для очистки міді (електролітичне рафінування).
Приклад 4. Яка кількість міді відновиться на катоді в результаті електрохімічного рафінування (див. приклад 3), якщо процес триває три години при силі струму 150 А?
Розв’язок. За законом Фарадея:
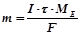 ,
,
де 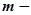 маса міді, г;
маса міді, г;
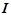 – сила струму, А;
– сила струму, А;
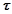 – час електролізу, секунд;
– час електролізу, секунд;
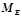 – еквівалентна маса міді, грам / моль-екв;
– еквівалентна маса міді, грам / моль-екв;
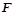 – стала Фарадея, 96500 Кл / моль- екв. (A× c / моль-екв)
– стала Фарадея, 96500 Кл / моль- екв. (A× c / моль-екв)
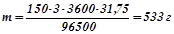 .
.
ЗАДАЧІ ТА ВПРАВИ
1. Записати рівняння процесів, що відбуваються на графітових електродах при електролізі водних розчинів:
а) калій хлориду;
б) купрум (ІІ) сульфату;
в) натрій нітрату.
2. Записати рівняння процесів, що відбуваються на електродах при електролізі водного розчину нікель сульфату з активним (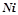 ) анодом.
) анодом.
3. Які речовини і в яких кількостях виділяються при електролізі водного розчину натрій хлориду, якщо процес проводити 4 години при силі струму 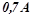 (електроди графітові)? Записати рівняння електродних процесів та сумарне рівняння електролізу.
(електроди графітові)? Записати рівняння електродних процесів та сумарне рівняння електролізу.
4. При електролізі водного розчину хлориду тривалентного металу протягом 1, 5 год при силі струму  на катоді виділилось
на катоді виділилось 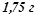 цього металу. Який це метал? Скласти рівняння процесів, що відбуваються біля інертних електродів.
цього металу. Який це метал? Скласти рівняння процесів, що відбуваються біля інертних електродів.
5. Скільки грамів срібла виділиться на катоді, якщо пропускати через розчин 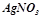 струм силою
струм силою 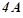 протягом 10 хв.? Які речовини і в яких кількостях виділяються при цьому на аноді? Скласти рівняння відповідних процесів.
протягом 10 хв.? Які речовини і в яких кількостях виділяються при цьому на аноді? Скласти рівняння відповідних процесів.
6. Визначити еквівалентну масу двохвалентного металу, знаючи, що при електролізі водного розчину хлориду цього металу затрачено 38600 кулонів електрики і на катоді виділилось 11, 74 г металу. Який це метал? Скласти рівняння процесів, що відбуваються, якщо:
а) електроди графітові;
б) електроди мідні.
7. При електролізі розчинів 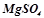 і
і  , з’єднаних послідовно з джерелом струму, на одному з катодів виділилось 0, 25 г
, з’єднаних послідовно з джерелом струму, на одному з катодів виділилось 0, 25 г 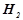 . Які речовини і в яких кількостях виділяються на іншому катоді та на анодах?
. Які речовини і в яких кількостях виділяються на іншому катоді та на анодах?
8. Електроліз розчину цинк сульфату проводили протягом 5 год, в результаті чого виділилось 6 л кисню (н.у.). Скласти рівняння електродних процесів і обчислити силу струму.
ЛІТЕРАТУРА: [ 1 – с. 262-272; 2 – с.; 252–255, 276-278;
3 – с. 324-325; 4 – с. 235-251].
|
|