
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Експериментальна частина. Дослід 1. Властивості магній оксиду та гідроксиду
|
|
Дослід 1. Властивості магній оксиду та гідроксиду
Невеличку кількість магній оксиду помістити в пробірку і долити  дистильованої води. Випробувати одержану речовину кількома краплями фенолфталеїну. Якого забарвлення набув розчин? Звернути увагу на малу розчинність одержаного магній гідроксиду. Записати рівняння реакції.
дистильованої води. Випробувати одержану речовину кількома краплями фенолфталеїну. Якого забарвлення набув розчин? Звернути увагу на малу розчинність одержаного магній гідроксиду. Записати рівняння реакції.
Злити рідину з частиною осаду в раковину. Осад, що залишився, розчинити у хлоридній кислоті (10%).
Записати рівняння реакцій магній гідроксиду з хлоридною кислотою при недостачі та при надлишку 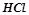 .
.
Дослід 2. Одержання та властивості основ
У три пробірки налити по 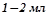 розчинів: у першу – амоній хлориду, в другу – барій хлориду, в третю – купрум (ІІ) сульфату. До кожного долити по
розчинів: у першу – амоній хлориду, в другу – барій хлориду, в третю – купрум (ІІ) сульфату. До кожного долити по  розчину лугу. Які зміни спостерігаються?
розчину лугу. Які зміни спостерігаються?
Записати рівняння реакцій та спостереження.
Розділити вміст кожної з пробірок надвоє, одержавши дві однакові групи пробірок.
Пробірки першої групи по черзі обережно нагріти на полум’ї пальника, безперервно струшуючи. Пояснити спостереження, подавши рівняння реакцій. Зробити висновок про термічну стійкість одержаних гідроксидів.
До осадів другої групи пробірок долити хлоридної кислоти (10%). Записати рівняння реакцій, відзначивши спостережені зміни. Зробити висновок про хімічний характер досліджуваних гідроксидів.
Дослід 3. Одержання та властивості амфотерного гідроксиду
У пробірку налити 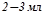 розчину алюміній сульфату. Обережно доливати розчин амоній гідроксиду до утворення осаду. Звернути увагу на вигляд осаду, записати рівняння реакції та спостереження.
розчину алюміній сульфату. Обережно доливати розчин амоній гідроксиду до утворення осаду. Звернути увагу на вигляд осаду, записати рівняння реакції та спостереження.
Розділити одержаний осад у 2 пробірки. В одну долити 10% розчин хлоридної кислоти, в іншу – 30% розчин лугу. Спостерігати розчинення осаду в обох пробірках. Записати рівняння реакцій та спостереження. Пояснити причину розчинення осаду і в кислоті, і в лугові, зробивши висновок про хімічний характер алюміній гідроксиду.
ЗАДАЧІ ТА ВПРАВИ
1. Записати формули оксидів за поданою валентністю елемента:  ;
; 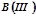 ;
;  ;
;  ;
; 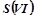 ;
; 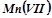 .
.
Вказати хімічний характер оксидів та записати формули відповідних їм гідратів.
2. Написати формули ангідридів кислот: 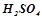 ;
; 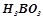 ;
;  ;
;  враховуючи, що ангідридами називаються кислотні оксиди.
враховуючи, що ангідридами називаються кислотні оксиди.
3. З якими з перелічених речовин буде реагувати хлоридна кислота:  ;
;  ;
; 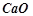 ;
;  ;
;  ;
; 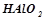 ;
;  ;
;  ;
; 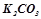 ;
; 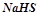 ? Написати рівняння реакцій.
? Написати рівняння реакцій.
4. Які з перелічених речовин будуть реагувати з натрій гідроксидом:  ;
;  ;
;  ;
; 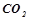 ;
; 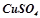 ;
;  ;
;  ;
; 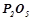 ;
; 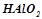 ;
; 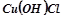 . Назвати вихідні речовини і продукти реакції.
. Назвати вихідні речовини і продукти реакції.
5. Дописати рівняння реакцій та назвати одержані продукти:
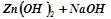 →
→
 →
→
 →
→
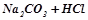 →
→
 →
→
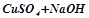 →
→
 →
→
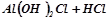 →
→
 →
→
ЛІТЕРАТУРА: [2 – c. 219-227; 3 – с. 173-216; 4 – с. 140-154].
ЗАНЯТТЯ № 7
Тема: ДОБУВАННЯ ОКСИДІВ, КИСЛОТ, ОСНОВ ТА СОЛЕЙ. ГЕНЕТИЧНИЙ ЗВ'ЯЗОК МІЖ КЛАСАМИ НЕОРГАНІЧНИХ СПОЛУК
Мета заняття: розглянути основні методи добування оксидів, кислот, основ та солей. Встановити генетичні зв’язки між основними класами неорганічних сполук.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Способи одержання оксидів.
2. Способи одержання кислот.
3. Способи одержання основ.
4. Способи одержання солей.
5. Генетичні зв’язки між класами неорганічних сполук.
ТЕОРЕТИЧНІ ВІДОМОСТІ
Способи одержання оксидів.
1. Взаємодія простих речовин з киснем. Більшість простих речовин під час нагрівання на повітрі або в кисні згоряють, утворюючи відповідні оксиди:
4Р + 5О2 = 2Р2О5;
2Mg + O2 = 2MgO.
2. Взаємодія складних речовин з киснем, зокрема горіння органічних речовин:
СН4 + О2 = СО2 + 2Н2О;
2Н2S + 3О2 = 2SO2 + 2Н2О.
3. Термічний розклад основ:
Са(ОН)2 = СаО + Н2О;
Hg(OH)2 = HgO + H2O.
4. Термічний розклад кислот:
4HNO3 = 4NO2 + 2Н2О + О2;
H2SiO3 = SiO2 + H2O.
|
|