
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Характеристика основних складових частин атома
|
|
| Назва | Символ | Маса (а.о.м.) | Заряд | Кількість в атомі |
| 1. Ядро | ||||
| Протон | 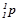
| +1 | Z | |
| Нейтрон | 
| N = A – Z | ||
| 2. Електронна оболонка | ||||
| Eлектрон | ē | 1/1836 | -1 | Z |
Порядковий номер елемента визначає величину позитивного заряду ядра, число протонів у ядрі та число електронів у нейтральному атомі.
Електронна оболонка – це сукупність електронів з однаковим запасом енергії.
Простір навколо ядра, де знаходження електрона найбільш ймовірне, називають орбіталлю. Орбіталі знаходяться на певних відстанях від ядра, мають певні форми і спосіб орієнтації в просторі.
Для характеристики стану електронів у атомі використовують набір чотирьох квантових чисел (кв. ч.). За допомогою трьох квантових чисел:  – головного,
– головного, 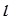 – орбітального (побічного),
– орбітального (побічного), 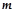 – магнітного, значення яких одержують із рівняння Шредингера, можна описати стан електрона при його русі навколо ядра. Четверте – спінове квантове число
– магнітного, значення яких одержують із рівняння Шредингера, можна описати стан електрона при його русі навколо ядра. Четверте – спінове квантове число  характеризує рух електрона навколо власної осі.
характеризує рух електрона навколо власної осі.
Головне квантове число  характеризує енергію електрона і визначає енергетичний рівень електрона в атомі.
характеризує енергію електрона і визначає енергетичний рівень електрона в атомі.
Енергетичний рівень – це сукупність орбіталей з однаковим значенням головного квантового числа  .
.
Головне квантове число набуває значень:  = 1, 2, 3, 4, 5, 6, 7…
= 1, 2, 3, 4, 5, 6, 7…
Відповідні позначення:
Головне квантове число 1 2 3 4 5 6 7;
Енергетичний рівень K L M N O P Q.
Електрони з однаковим значенням n перебувають на одному енергетичному рівні.
Чим далі від ядра, тим вищий за енергією енергетичний рівень.
Орбітальне (побічне) квантове число 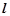 визначає форму орбіталі і уточнює значення енергії електрона в межах енергетичного рівня. Визначає енергетичний підрівень. Набуває значень від 0 до (
визначає форму орбіталі і уточнює значення енергії електрона в межах енергетичного рівня. Визначає енергетичний підрівень. Набуває значень від 0 до ( ). Числовим значенням
). Числовим значенням 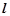 відповідають буквенні позначення енергетичних підрівнів:
відповідають буквенні позначення енергетичних підрівнів:
побічне квантове число 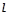 : 0, 1, 2, 3;
: 0, 1, 2, 3;
енергетичний підрівень: s, p, d, f.
Кожному значенню  відповідають орбіталі певної форми. Орбіталь
відповідають орбіталі певної форми. Орбіталь  -підрівня має форму кулі, орбіталі
-підрівня має форму кулі, орбіталі  - підрівня – об’ємної «вісімки»,
- підрівня – об’ємної «вісімки», 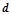 - підрівень – комбінація «вісімок» або «вісімки» і тора. Електрони, що перебувають у
- підрівень – комбінація «вісімок» або «вісімки» і тора. Електрони, що перебувають у  - станах, називають відповідно
- станах, називають відповідно 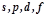 - електронами.
- електронами.
Кожному енергетичному рівню з пeвним значенням n відповідає набір енергетичних підрівнів із значенням 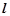 від 0 до (
від 0 до ( 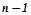 ).
).
Eлектрони, що знаходяться на одному енергетичному підрівні, по різному взаємодіють з магнітним полем атома. Електромагнітні властивості електрона визначає магнітне квантове число.
Магнітне квантове число 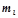 показує орієнтацію електронної орбіталі у просторі. Для кожного даного значення
показує орієнтацію електронної орбіталі у просторі. Для кожного даного значення  ml може набувати значень цілих чисел натурального ряду від
ml може набувати значень цілих чисел натурального ряду від 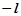 до
до  :
:
 .
.
Спінове квантове число  визначає момент кількості руху електрона при його русі навколо власної осі. Приймає два значення:
визначає момент кількості руху електрона при його русі навколо власної осі. Приймає два значення:
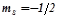 ;
; 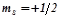 .
.
Розподіл електронів на енергетичних рівнях атома відбувається відповідно до таких правил.
Принцип Паулі
В атомі не може бути навіть двох електронів з однаковими значеннями всіх чотирьох квантових чисел, тобто на одній орбіталі знаходиться не більше 2-х електронів, які мають протилежні спіни.
Орбіталь з 2-ма електронами, спіни яких протилежні – квантова комірка.
За принципом Паулі можна розрахувати максимальне число електронів на орбіталі, підрівні, рівні. На кожній орбіталі – по  , тому на
, тому на  - підрівні –
- підрівні –  ; на
; на  - підрівні –
- підрівні – 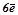 ; на
; на  - підрівні –
- підрівні –  ; на
; на  - підрівні –
- підрівні –  . Максимальне число електронів на енергетичному рівні
. Максимальне число електронів на енергетичному рівні 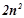 , де
, де  – головне квантове число.
– головне квантове число.
Принцип найменшого запасу енергії
Електрони в атомах розміщуються на енергетичних рівнях і підрівнях у порядку зростання їх енергії, починаючи від найменшої, тобто в порядку зростання суми ( ). Заповнення відбувається в такій послідовності:
). Заповнення відбувається в такій послідовності:
1s–2s–2p–3s–3p–4s–3d–4p–5s–4d–5p–6s–5d1–4f–5d2-10–6p–7s–6d1–5f–6d2-10–7p.
Правило Гунда
У межах даного підрівня електрони розміщуються так, щоб модуль суми їх спінових чисел був максимальним. Тому електрони на підрівні займають орбіталі спочатку по одному на орбіталь, а потім – по двоє.
Будову електронних оболонок атомів відображають за допомогою електронних формул або конфігурацій. Електронна формула – це умовне зображення розподілу електронів по орбіталях на енергетичних рівнях і підрівнях. Наприклад:

енергетичний рівень
Електронні формули атомів Сульфуру і Хрому:




Графічні зображення враховують значення спінового квантового числа. Наприклад, 2 електрони з протилежними спінами на орбіта лі 1s зображують так:
 1s2.
1s2.
ЗАДАЧІ ТА ВПРАВИ
1. Яке максимальне число електронів можуть мати  -,
-,  -,
-, 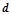 -,
-,  -, орбіталі? Чому? Записати електронні формули атомів елементів з порядковими номерами 4, 9, 21. До якого електронного сімейства відноситься кожний із цих елементів?
-, орбіталі? Чому? Записати електронні формули атомів елементів з порядковими номерами 4, 9, 21. До якого електронного сімейства відноситься кожний із цих елементів?
2. Скласти електронні формули атомів елементів ІІІ періоду. В чому подібність і відмінність в будові їх атомів?
3. Скласти електронні формули елементів IV групи:  ;
;  ;
; 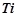 . В чому подібність і відмінність електронних структур атомів елементів головної та побічної підгруп?
. В чому подібність і відмінність електронних структур атомів елементів головної та побічної підгруп?
4. Зобразити графічно електронні структури атомів Фосфору та Ванадію, обґрунтувати подібність та різницю в їх властивостях.
5. Описати системою квантових чисел стан електронів: 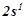 ;
; 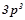 ;
; 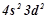 .
.
6. Під час взаємодії невідомого металу масою 2 г з водою виділилось 1, 12 л водню (н.у.). Метал належить до II групи періодичної системи хімічних елементів.
7. Вищий оксид невідомого елемента має формулу Е2О5. масова частка Гідрогену в сполуці цього елемента з Гідрогеном становить 17, 65%. Складіть формули сполук елемента з Магнієм та Силіцієм, назвіть їх.
8. Природний Купрум складається з двох нуклідів 63Сu та 65Cu. Відносна атомна маса Купруму становить 63, 55. Обчисліть масову частку 63Сu у природному Купрумі.
ЛІТЕРАТУРА: [1- c. 28-60; 2 – c. 24-48; 3 – c. 21-39; 4 – с. 21-47, 1-66]
ЗАНЯТТЯ № 5
Тема: ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА
Мета заняття: з’ясувати суть періодичного закону і будову періодичної системи та їх взаємозв’язок з будовою атома. Навчитись характеризувати властивості елемента, виходячи з його місця в періодичній системі.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Cучасне формулювання періодичного закону.
2. Структура періодичної системи: періоди, групи, підгрупи.
3. Фізичний зміст періодичного закону, номера періоду, номера групи, підгрупи.
4. Розміщення 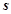 -,
-,  -,
-, 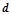 -,
-, 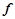 - елементів у періодичній системі.
- елементів у періодичній системі.
5. Визначення понять – «енергія іонізації», «енергія спорідненості до електрона», «відносна електронегативність». Як змінюються названі величини в залежності від радіуса атома елемента в періодах і групах?
6. Як змінюються властивості елементів у періодах і групах? Місце металів і неметалів у періодичній системі. Хімічний характер оксидів та їх гідратів відповідно до місця елемента в періодичній системі.
ТЕОРЕТИЧНІ ВІДОМОСТІ
Сучасне формулювання періодичного закону: властивості елементів та їх сполук перебувають у періодичній залежності від величини заряду ядер атомів.
Періодична система є графічним відображенням періодичного закону. Вона складається із семи періодів і восьми груп.
Період – це горизонтальний ряд (чи два ряди), де елементи розміщені в порядку зростання порядкового номера (протонного числа). Період, який складається з одного ряду – малий, з двох рядів (парного і непарного) – великий.
Група – це вертикальний стовпчик, у якому розміщені подібні за властивостями елементи. Група складається з підгруп: головної і побічної. До однієї підгрупи належать елементи з однаковою будовою зовнішнього енергетичного рівня. Вони є електронними аналогами.
Елементи, в атомах яких останнім заповнюється 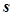 - підрівень, називаються s - елементами, вони розміщуються в головних підгрупах I-II груп. Електронна формула їх зовнішнього енергетичного рівня
- підрівень, називаються s - елементами, вони розміщуються в головних підгрупах I-II груп. Електронна формула їх зовнішнього енергетичного рівня 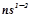 .
.
Елементи, в атомах яких останнім заповнюється  - підрівень, називаються
- підрівень, називаються  - елементами, вони розміщуються в головних підгрупах III-VIII груп. Електронна формула зовнішнього енергетичного рівня їх атомів
- елементами, вони розміщуються в головних підгрупах III-VIII груп. Електронна формула зовнішнього енергетичного рівня їх атомів 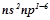 .
.
Елементи, в атомах яких останнім заповнюється 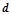 - підрівень, називаються
- підрівень, називаються 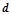 - елементами, вони займають всі побічні підгрупи. Електронна формула зовнішнього енергетичного рівня
- елементами, вони займають всі побічні підгрупи. Електронна формула зовнішнього енергетичного рівня  .
.
 - елементи – лантаноїди, актиноїди, належать до ІІІ групи, побічної підгрупи. Вони виділені в окремі ряди у кінці таблиці. Електронна формула:
- елементи – лантаноїди, актиноїди, належать до ІІІ групи, побічної підгрупи. Вони виділені в окремі ряди у кінці таблиці. Електронна формула:  .
.
Електронна будова зовнішнього енергетичного рівня атома визначає хімічний характер елемента. Елементи, атоми яких мають 1 - 2 електрони на зовнішньому  - підрівні, проявляють металічні властивості. Таку будову мають
- підрівні, проявляють металічні властивості. Таку будову мають  - і
- і  - елементи.
- елементи.
 - елементи – типові метали (крім
- елементи – типові метали (крім  і
і  ), їх оксиди – основні, а гідрати оксидів – основи. Металічні властивості елементів і основний характер сполук посилюється у групах із збільшенням порядкового номера. Виняток: оксид і гідроксид берилію мають амфотерні властивості.
), їх оксиди – основні, а гідрати оксидів – основи. Металічні властивості елементів і основний характер сполук посилюється у групах із збільшенням порядкового номера. Виняток: оксид і гідроксид берилію мають амфотерні властивості.
 - елементи – перехідні метали. У низьких ступенях окиснення (+1, +2, +3) їх оксиди і гідроксиди основні, у вищих ступенях окиснення (+5, +6, +7, +8) – оксиди та гідроксиди кислотні. У проміжних ступенях окиснення (+3, +4) оксиди та гідроксиди мають переважно амфотерний характер.
- елементи – перехідні метали. У низьких ступенях окиснення (+1, +2, +3) їх оксиди і гідроксиди основні, у вищих ступенях окиснення (+5, +6, +7, +8) – оксиди та гідроксиди кислотні. У проміжних ступенях окиснення (+3, +4) оксиди та гідроксиди мають переважно амфотерний характер.
 - елементи – як
- елементи – як 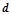 - елементи.
- елементи.
 - елементи: діагональ В – At ділить
- елементи: діагональ В – At ділить  - елементи на
- елементи на 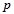 - метали і
- метали і  - неметали. Верхній правий кут-неметали, лівий нижній –
- неметали. Верхній правий кут-неметали, лівий нижній –  - метали. Оксиди і гідрати оксидів
- метали. Оксиди і гідрати оксидів  - неметалів виключно кислотні, а
- неметалів виключно кислотні, а  - металів, як правило, амфотерні. Виняток становить VIII група – інертні гази, через завершеність зовнішнього енергетичного рівня вони не утворюють сполук валентного характеру.
- металів, як правило, амфотерні. Виняток становить VIII група – інертні гази, через завершеність зовнішнього енергетичного рівня вони не утворюють сполук валентного характеру.
ЗАДАЧІ ТА ВПРАВИ
1. Виходячи із положення елементів Фосфору, Магнію і Мангану в періодичній системі, дати їх загальну характеристику за таким планом:
а) електронна формула атома та розподіл електронів по енергетичних комірках;
б) положення в періодичній системі (період, група, електронне сімейство, підгрупа);
в) вищий та нижчий ступені окиснення елемента, відповідні сполуки з Оксигеном та Гідрогеном.
г) хімічний характер оксидів та їх гідратів.
2. Охарактеризувати властивості елементів, які мають таку електронну конфігурацію: … 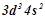 ;
; 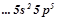 ;
;  ; Назвати ці елементи.
; Назвати ці елементи.
3. Виходячи з положення Молібдену, Ренію і Телуру в періодичній системі, cкласти формули таких сполук: молібденової та телурової кислот, вищого оксиду ренію, водневої сполуки телуру.
4. Який нижчий та вищий ступінь окиснення проявляють Карбон, Фосфор, Сульфур, Іод? Чому? Скласти формули сполук цих елементів, які відповідають таким ступеням окиснення.
5. Вищий оксид елемента, який належить до V групи періодичної системи, має відносну молекулярну масу 142. Визначте невідомий елемент, зобразіть електронну конфігурацію його атома, вкажіть можливі валентні стани, складіть формули оксидів та гідроксидів, вкажіть їх характер.
6. Елемент А, що належить до головної підгрупи IV групи періодичної системи, утворює сполуку з Хлором, в якій масова частка Хлору становить 92, 21%. Запишіть формулу вищого оксиду, утвореного елементом А, вкажіть його характер.
ЛІТЕРАТУРА: [1- c. 28-60; 2 – c. 24-48; 3 – c. 21-39; 4 – с. 21-47, 1-66]
ЗАНЯТТЯ № 6
Тема: ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
Мета заняття: розглянути основи класифікації неорганічних сполук. Ознайомитися з їх хімічними властивостями.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Що таке оксиди? На які групи поділяють оксиди за хімічним характером?
2. Навести приклади несолетвірних та амфотерних оксидів.
3. Хімічні властивості основ. Навести приклади реакцій.
4. Хімічні властивості кислот. Навести приклади реакцій.
5. Класифікація солей.
ТЕОРЕТИЧНІ ВІДОМОСТІ
Поділ складних речовин на класи за функціональними ознаками полегшує вивчення їх хімічних властивостей.
Найважливішими класами неорганічних сполук є:
1) оксиди;
2) гідрати оксидів (гідроксиди):
- основи;
- кислоти;
- амфотерні гідроксиди;
3) солі.
Оксиди
Оксидами називають складні речовини, молекули яких складаються з двох елементів, одним з яких є Оксиген у ступені окиснення -2. Наприклад,
карбон (IV) оксид:  , структурна формула
, структурна формула 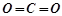 ;
;
бор оксид: 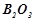 , структурна формула
, структурна формула  .
.
Оксиди бувають солетвірні і несолетвірні. Несолетворні (байдужі) оксиди не утворюють солей:
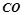 ;
;  ;
;  ;
; 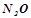 .
.
Оксиди, які під час хімічних реакцій утворюють солі, називаються солетвірними. За хімічним характером оксиди поділяються на основні, кислотні та амфотерні.
Основними називаються оксиди, гідратами яких є основи. Їх утворюють  -,
-,  -,
-, 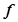 - метали у низьких ступенях окиснення (+1, +2):
- метали у низьких ступенях окиснення (+1, +2):
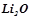 ;
;  ;
;  ;
;  ;
;  ;
;  ;
;  ;
;  .
.
Кислотними називаються оксиди, гідратами яких є кислоти. Такі оксиди називають ангідридами кислот. Їх утворюють неметали у всіх додатніх ступенях окиснення і  - та
- та 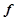 - метали у високих ступенях окиснення (+5 і вище):
- метали у високих ступенях окиснення (+5 і вище):
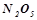 ;
; 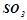 ;
; 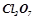 ;
; 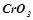 ;
;  ;
;  ;
;  .
.
Амфотерними називаються оксиди, які залежно від умов можуть виявляти і основні, і кислотні властивості. Їх утворюють  -метали,
-метали,  - і
- і 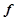 - метали у проміжних ступенях окиснення, а також
- метали у проміжних ступенях окиснення, а також 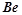 і
і  :
:
 ;
; 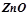 ;
; 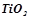 ;
;  ;
;  ;
;  ;
; 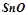 ;
; 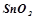 ;
; 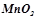 ;
; 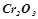 .
.
Хімічні властивості
Основні оксиди:
- реагують з кислотними оксидами і з кислотами:
 ;
;
 ;
;
- оксиди лужних і лужноземельних металів реагують з водою, утворюючи основи:
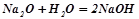 .
.
Кислотні оксиди:
- реагують з основними оксидами і з основами:
 ;
;
 ;
;
- як правило, реагують з водою, утворюючи кислоти:
 .
.
Амфотерні оксиди:
- з водою не взаємодіють;
- з кислотними оксидами і кислотами взаємодіють, як основні оксиди:
 ;
;
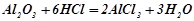 ;
;
- з основними оксидами і основами взаємодіють, як кислотні оксиди:
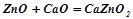 ;
;
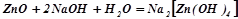 (у розчині);
(у розчині);
 (при сплавленні).
(при сплавленні).
Основи
Основами називаються сполуки, які складаються з катіонів металу (або 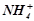 ) і з гідроксогруп
) і з гідроксогруп 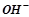 :
: 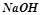 – натрій гідроксид,
– натрій гідроксид,  – кальцій гідроксид,
– кальцій гідроксид,  – амоній гідроксид. Число груп
– амоній гідроксид. Число груп 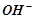 , здатних заміщуватись на кислотні залишки з утворенням солей, називається кислотністю основи. Із збільшенням ступеня окиснення металу основні властивості його гідроксиду послаблюються.
, здатних заміщуватись на кислотні залишки з утворенням солей, називається кислотністю основи. Із збільшенням ступеня окиснення металу основні властивості його гідроксиду послаблюються.
За теорією електролітичної дисоціації основи – це електроліти, які у водному розчині дисоціюють з утворенням лише гідроксид-іонів.
Основи, утворені лужними і лужноземельними металами добре розчиняються і дисоціюють у воді. Такі сильні розчинні основи називаються лугами. Слабкі основи дисоціюють у водних розчинах незначною мірою.
Дисоціація сильної основи:
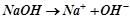 .
.
Дисоціація слабкої основи – оборотній процес, при якому встановлюється рівновага:
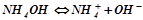 .
.
Основи з кількома групами ОН– дисоціюють ступінчато.
І ступінь: 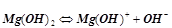 ;
;
ІІ ступінь: 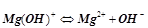 .
.
Хімічні властивості
Взаємодія з кислотними оксидами і з кислотами:
 ;
;
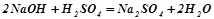 .
.
Взаємодія з амфотерними оксидами і гідроксидами:
 ;
;
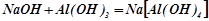 .
.
Взаємодія з солями:
- середніми (сильніша основа 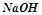 витісняє з солі слабку
витісняє з солі слабку 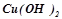 ):
):
 ;
;
- кислими (реакція нейтралізації):
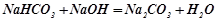 ;
;
- основними (витіснення слабкої основи):
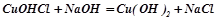 .
.
|
|