
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кровообращение
|
|
Основная функция системы кровообращения – транспорт крови и содержащегося в ней кислорода в соответствии с метаболическими потребностями организма. Играя существенную роль во всех процессах, обеспечивающих его жизнедеятельность, система обладает как высокой избирательностью по отношению к изменениям внутренней среды, так и адаптационной стабильностью к внешним воздействиям.
Система кровообращения выполняет объем работы, во многом превосходящий возможности аналогичных технических устройств. За период жизни сердце производит в среднем около 3 млрд. сокращений. Суммарный объем крови, перемещаемой при этом, составляет около ½ кубического километра, в то время как объем полостных образований сердца измеряется всего лишь миллилитрами. При физической нагрузке значения ударного объема крови (УОК) могут увеличиваться до 200 % и более, а минутного объема кровообращения (МОК) - до 500 %, что свидетельствует о высокой функциональной вариабельности системы кровообращения и ее больших адаптационных возможностях.
В поддержании необходимого уровня гемодинамики ведущая роль отводится насосной функции сердца, транспортно-демпферной (сосудистой) субсистеме кровообращения и объему циркулирующей крови (ОЦК). Наиболее динамичными являются насосная функция сердца и функциональное состоянии сосудов: им принадлежит основная роль в реализации срочных адаптивных реакций.
Одна из задач, решаемая системой кровообращения, заключается в обеспечении множества бассейнов микроциркуляции необходимым количеством крови. Однако функция ее при этом заключается не просто в поддержании определенного объема кровообращения и его рациональном распределении, а в своевременном изменении объемного кровотока в соответствии с постоянно меняющимися потребностями тканей в кислороде. Общая схема распределения объема циркулирующей крови (ОЦК), пульсового (ПД) и среднединамического давлений (СДД) в основных сосудистых бассейнах представлена на рис. 3.15. Из него видно, что гемодинамический процесс весьма сложен и, по крайней мере, не является статичным.

Рис. 3.15. Внутрисосудистое давление и объем крови в различных отделах сосудистого русла. Прерывистая линия – среднее артериальное давление (мм рт. ст.), прямоугольники – пульсовое давление (мм рт. ст.), цифры внизу – объем крови в сосудах (% к общему объему)
Интегральным показателем функции кровообращения принято считать показатель минутной производительности сердца, подобно тому, как при оценке функции дыхания наиболее универсальным является уровень оксигенации венозной крови, оттекающей из малого круга к левому предсердию. Однако ни производительность сердца, ни артериальное давление или частота пульса, когда они берутся изолированно, не могут дать полного представления об адекватности сердечного выброса кислородному обмену, а также о степени функциональной напряженности системы кровообращения. Так, при гиперфункции гемодинамики минутный объем растет вместе с потреблением кислорода в линейной зависимости - взаимосвязь кровообращения с внешним и тканевым дыханием здесь очевидна. В случае снижения производительных параметров кровообращения лимитирующим фактором при подавляющем большинстве патологических состояний оказывается сердечный выброс. Поэтому оценка функции сердечно-сосудистой системы должна учитывать не только параметры, свидетельствующие об уровне ее производительности, но и степень снабжения тканей кислородом и уровень потребления ими последнего. При оценке производительности сердечно-сосудистой системы необходимо учитывать минутный объем кровообращения (МОК), общее потребление кислорода (ПО2) и напряжение (содержание) кислорода в смешанной венозной крови (РvО2).
Должные (расчетные) величины сердечной производительности. Величина МОК в значительной мере зависит от антропометрических данных исследуемого, в связи с чем она подвержена большому разбросу. Поэтому для сравнения производительной функции сердца у разных больных применяют сердечный индекс (СИ). Он отражает МОК, отнесенный к поверхности тела в м2. Единицей размерности СИ является л·мин –1·м –2, в норме он составляет 3, 1±0, 7.
Современные представления о производительной функции сердца опираются на исследования Н.Н. Савицкого и соавт. (1970, 1974), в которых была показана прямая связь между должным основным обменом (ДОО) и должным минутным объемом кровообращения (ДМОК). По данным Н.Н. Савицкого:
 (3.29),
(3.29),
где: ДМОК - должный минутный объем кровообращения для условий основного обмена (л·мин-1);
ДОО - должный основной обмен (ккал/сут);
422 - индекс Савицкого.
Расчет ДОО при этом осуществляется раздельно для мужчин и для женщин по формулам, приведенным ниже:
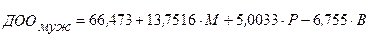 (3.30),
(3.30),
где: ДОО - должный основной обмен (ккал/сутки);
М - масса тела (кг);
Р - рост (см);
В - возраст (лет).
 (3.31),
(3.31),
(обозначения те же, что и в формуле 3.30).
С учетом того, что условия основного обмена в клинике создать практически невозможно, должный минутный объем кровообращения рассчитывают для условий покоя, применяя для этого индекс Г.П. Звонарева (1974), который составляет 1, 35. Формула расчета должного минутного объема кровообращения для условий покоя в этом случае приобретает вид:
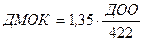 (3.32),
(3.32),
(обозначения те же, что и в формуле 3.29).
Расчет сердечного индекса осуществляют делением МОК на площадь поверхности тела (ПТ) в м2:
 (3.33),
(3.33),
где: СИ - сердечный индекс (л/минм-2); МОК - минутный объем кровообращения (л·мин-1); ПТ - поверхность тела (м2).
В свою очередь расчет ПТ осуществляется по формуле Дюбуа и Дюбуа (1916):
 (3.34),
(3.34),
где: ПТ - поверхность тела (м2);
М - масса тела (кг);
Р - рост (см).
Уместно напомнить, что уравнение (3.34) основано на прямом измерении тела только 9 испытуемых. Но, несмотря на это, оно нашло широкое применение и до настоящего времени считается вполне надежным.
Энергетика миокарда. Структурно-функциональная специализация сердца призвана обеспечивать его главное предназначение – насосную деятельность. Хотя в обеспечении кровообращения принимают участие сосудистые и другие механизмы, роль сердечного насоса является определяющей. Сократительная способность миокарда является одним из важнейших компонентов, обеспечивающих нагнетательную функцию и участвующих в регуляции сердечного выброса. Главным условием здесь считается полное соответствие сердечного выброса и венозного возврата крови при стационарном режиме работы сердца и быстрое их выравнивание при меняющихся режимах.
Известно, что энергетика сердца значительно отличается от энергетики скелетных мышц преобладанием аэробных процессов, в которых синтезируются макроэргические фосфаты. Важнейшей особенностью сердечного энергообмена является линейная зависимость между механической работой сердца и скоростью потребления миокардом кислорода. В физиологических условиях основная часть энергии сердца получается в результате гидролиза жирных кислот, протекающего только в аэробных условиях (цикл Кребса). Синтезирующиеся при этом ацетилкоэнзим А и пируват окисляются поэтапно до CO2 и ионов Н+. Освобождающиеся атомы водорода переносятся на цепь транспорта электронов цитохромной системой (дыхательная цепь), где используются для восстановления молекулярного кислорода до воды. Образующаяся при переносе электронов на дыхательную цепь энергия идет на ресинтез АТФ.
Основные механизмы регуляции силы сердечных сокращений достаточно хорошо объясняет теория актинмиозинового скольжения. Первый из таких механизмов реализуется через отношение длина-сила (закон Франка-Старлинга, рис. 3.16.).Чем больше длина саркомера перед сокращением, тем больше потенциально возможное возрастание зоны актинмиозинового перекрытия и, следовательно, – больше генерируемый прирост силы. Второй эффект заключается в приросте силы при неизменяемой длине саркомера в ответ на возрастающее сопротивление сокращению. Это приводит к замедлению сокращения, т. е. к зависимости сила - скорость. В этом случае процесс скольжения оказывается замедленным, что увеличивает время контакта головок актинмиозиновых мостиков с активными локусами саркомеров, чем и объясняется прирост силы. Кроме того, существует ряд факторов, оказывающих влияние на силу сокращений через усиленное поступление в саркомеры внеклеточного кальция или увеличение частоты сердечных сокращений (хроноинотропный эффект), а также через катехоламиновые (медиаторные) воздействия.

Рис. 3.16. Воспроизведение одной из записей, полученных Старлингом на сердечно-легочном препарате. Запись на закопченной ленте кимографа показывает влияние увеличения венозного давления наполнения (I, без калибровки) на диастолический и систолический объемы сердца. II - артериальное давление в мм рт. ст., калибровочные отметки (100 и 75 мм рт. ст.) нанесены ниже; III - непрерывная запись объема обоих желудочков, полученная при помощи кардиометра (жесткой латунной камеры, в которую помещены желудочки; во время диастолы воздух из этой камеры вытесняется в измерительный цилиндр). Шкала прокалибрована в мл. Отметка времени - 1 с. (А). Исходное состояние: венозное давление 95 мм вод. ст., производительность желудочков 520 мл·мин-1. (Б). Быстрое повышение венозного давления до 145 мм вод. ст. Обратите внимание на соответствующее увеличение как диастолического объема желудочков, так и их ударного объема. Производительность желудочков 840 мл·мин-1 (В). Быстрое снижение венозного давления до 55 мм вод. ст. Как диастолический, так и ударный объем желудочков падают ниже исходного уровня. Производительность желудочков 200 мл·мин-1. (Patterson, Piper, Starling. The regulation of the heart-beat // J. Physio L., 1914, 48, 465)
Одним из критериев эффективности насосной функции является коэффициент полезной деятельности (КПД) сердца. Под ним понимают удельную энергетическую стоимость полезной (внешней) работы. Общие энергетические затраты расходуются сердцем на работу в качестве насоса, электромеханическое сопряжение, теплообразование, активный транспорт веществ через мембраны, биосинтез, структурное обновление клеток и т.п. Весь расход энергии сердцем выражается через энергетический эквивалент утилизированного сердцем кислорода или:
 (3.35),
(3.35),
где: 2, 057 Ккал/мл - энергетический эквивалент 1, 0 мл кислорода,
ПО2М - потребление миокардом кислорода за один сердечный цикл.
КПД сердца при этом представляется как отношение внешней работы к калорической ценности утилизированного кислорода. Вместе с тем, определить ПО2М даже в условиях клиники сложно. Возможно поэтому данные о нормальных значениях КПД сердца противоречивы и колеблются от 10 до 40 %.
Амплитудно-временнá я организация сердечного цикла. В контексте формирования производительной функции сердечно-сосудистой системы чрезвычайно велико значение амплитудно-временнό й организации сердечного цикла. Наиболее общее разделение цикла сердечной деятельности на систолу и диастолу соответствует начальным представлениям о динамике сердца. Еще Гарвей (Harvey, 1628) представлял его работу как цикл, состоящий из трех фаз: систолы, диастолы и паузы. Этой точки зрения придерживались, в частности, и основоположники отечественной физиологии И.П. Павлов (1883), Б.Ф. Вериго (1905), И.М. Сеченов (1923).
Дальнейшая дифференциация фазовой структуры сердечного цикла предполагает разделение систолы на период напряжения желудочков (PEP - pre-ejection period) и изгнания из них крови (LVEP - left ventricular ejection period), а диастола - на периоды расслабления мускулатуры желудочков (IVRP - isovolumic relaxation period) и наполнения их кровью (FP - filling period).
Уиггерс (Wiggers C.J., 1929) разделил сердечный цикл на фазу изометрического сокращения, фазы максимального и редуцированного изгнания, протодиастолу, фазы изометрического расслабления, быстрого и медленного наполнения и систолу предсердий. В настоящее время эта схема дополнена фазой асинхронного сокращения, протосфигматическим и интерсистолическим интервалами. Сердечный цикл, таким образом, может быть разбит на 11 периодов (рис. 3.17).

Рис.3.17. Периоды и интервалы сердечного цикла (мс, при ЧСС = 60 в 1 мин)
Представляют интерес не только абсолютные, но и относительные величины указанных периодов по отношению к длительности сердечного цикла, поскольку наряду с частотной зависимостью, при разных уровнях функционирования гемодинамики происходит изменение конфигурации сердечного цикла. Очевидно, что такое изменение имеет своей целью рациональное перераспределение внутрисердечных объемов крови для большей согласованности между контрактильными возможностями миокарда и уровнем потребления кислорода тканями. Так, по данным импедансометрии, в ответ на стандартную физическую нагрузку (10 присаживаний в постели из положения лежа в положение сидя) помимо прироста разовой производительности сердца и частоты сердечных сокращений (ЧСС), происходит закономерное укорочение периодов сердечного цикла за счет учащения сердцебиений (рис. 3.18). Обращает на себя внимание неравномерность такого укорочения. Как показано на рисунке, наибольшей стабильностью отличается период изгнания (LVEP), так как именно в этот период происходит главное событие сердечного цикла - сокращение миокарда. Наименее «устойчивыми» периодами, как правило, являются период расслабления (IVRP) и период наполнения (FP).

Рис.3.18. Изменения показателей гемодинамики и временных интервалов сердечного цикла в ответ на функциональную нагрузку в процентах к исходному состоянию (M±m, n=106)
Коронарное кровообращение. Уровень кислорода в миокарде зависит от состояния коронарного кровотока. При этом потребность мышцы сердца в О2 определяется внутрижелудочковым давлением, ЧСС и контрактильностью. Рост систолического давления вызывает рост потребления О2 в соотношении 1: 1. Учащение сердечного ритма вдвое увеличивает потребление О2 на 50%. Усиление контрактильности вдвое также увеличивает потребление О2 на 50%. Таким образом, использование сердечных резервов неизбежно связано с увеличением потребления О2 миокардом (В.А. Константинов, 1981).
Снабжение кислородом любого органа может быть увеличено за счет объемного кровотока и повышения содержания О2 в артериальной крови. Усиление экстракции кислорода в тканях при этом рассматривается как дополнительный источник увеличения доставки. Однако для сердца практически единственным источником прироста доставки кислорода является увеличение коронарного кровотока, так как экстракция его здесь велика даже в покое.
Одним из наиболее мощных регуляторов притока крови к сердцу является гипоксия. При ней дилятация венечных сосудов максимальна, а сопротивление в них наименьшее. Однако если гипоксия сопровождается тахисистолией, резервов для увеличения коронарного кровотока практически нет. Причина этому - значительное укорочение периода диастолы по сравнению с систолой за счет увеличения частоты сердечных сокращений. Как результат – увеличение тахисистолии сопровождается снижением производительной функции сердца.
Кривые давления и кровотока в аорте и кровотока в левой коронарной артерии приведены на рис. 3.19. Из него следует, что во время диастолы через парную артерию протекает значительно больший объем крови, чем во время систолы (Gregg, Fisher, 1962).

Рис.3.19. Временнá я организация сердечного цикла. Рисунок составлен на основании данных различных авторов для ЧСС 60 уд. в 1 мин.; вертикальными линиями выделены 11 периодов и интервалов сердечного цикла.
Ударный объем крови и факторы, его определяющие. Известно, что изменение числа сердечных сокращений за определенный промежуток времени само по себе, как правило, не приводит к значимым изменениям производительных параметров работы сердца. Повышение частоты сердечных сокращений вдвое может повысить производительность сердца всего на несколько процентов, а при дальнейшем нарастании тахикардии сердечная производительность может снижаться. С той же долей уверенности можно говорить об отсутствии значимого влияния на производительную функцию сердца артериального сопротивления, формирующегося в артериальной компрессионной камере по мере выхода крови из желудочков. Только очень высокое (240 и более мм рт. ст.) артериальное давление существенно влияет на сердечный выброс. Само по себе увеличение силы сокращения желудочков также не в состоянии обеспечить устойчивое увеличение МОК. Рост и частоты, и силы сокращений сердца, снижение постнагрузки – это лишь условия возможности повышения его производительности, для реализации которого необходимо также увеличение притока крови к сердцу.
При мышечной работе последнее достигается сочетанием снижения сопротивления сосудов работающих мышц, ограничения роста объема вен (за счет увеличения их жесткости), работы мышечного насоса, повышения центрального венозного давления (ЦВД) и изменения временных характеристик работы сердца. При этом необходимо помнить, что по достижении определенного уровня (обычно 12-14 см вод. ст.) ЦВД перестает влиять на прирост сердечной производительности.
В течение ряда лет механизм снижения прироста сердечной производительности в ответ на дальнейшее увеличение венозного возврата считался основным в развитии сердечной недостаточности кровообращения, которую приписывали растяжению мышечных волокон сердца сверх каких-то функциональных пределов. В настоящее время данная концепция пересмотрена. Снижение прироста производительности обусловлено нарастанием недостаточности атрио-вентрикулярного клапана - по мере расширения желудочка клапанное отверстие оказывается настолько увеличенным, что часть изгоняемой из желудочка крови возвращается через него в предсердие.
Резервы сердечно-сосудистой системы и основные механизмы компенсации. Тахисистолия - один из начальных компенсаторных факторов, быстрых и эффективных. Однако при прогрессировании экономически невыгоден, ухудшает коронарное кровообращение (за счет укорочения периода диастолы).
Увеличение ударного объема (УОК). Реализуется через увеличение венозного тонуса (что приводит к увеличению давления наполнения желудочков); через венозное увеличение растяжимости сердца; через падение сосудистого сопротивления в артериальной компрессионной камере и, наконец, через увеличение миокардиальной контрактильности. Последнее может быть первичным или реализоваться через медиаторные и гуморальные факторы.
Дилятация сердца. В сущности, данный механизм компенсации осуществляется в соответствии с законом Франка-Старлинга. При этом необходимо учитывать, что он повышает количество выполняемой работы и требует увеличения затрачиваемой энергии. Здесь уместно вспомнить закон Лапласа, согласно которому (применительно к желудочку сердца):
P = T/R (3.36),
Где: P – внутрижелудочковое давление;
T – напряжение стенки желудочка;
R - радиус желудочка.
В соответствии с этим законом, при дилятации сердца с увеличением радиуса его желудочка для поддержания исходного давления потребуется развивать большее напряжение. Это, в свою очередь, влечет за собой повышение расхода О2 и снижение эффективности работы сердца. Так как площадь поперечного сечения желудочка сердца равна pR2, то увеличение радиуса желудочка в 2 раза должно вызывать увеличение напряжения в 4 раза (Б.А. Константинов, 1981).
Гипертрофия миокарда - суммарное увеличение массы сердца за счет увеличения массы отдельных мышечных волокон. По сравнению с дилятацией – более совершенный, но и более медленно развивающийся тип компенсации. До определенных границ гипертрофия обратима, а в далеко зашедших случаях она приводит к срыву компенсации, так как доказано, что при увеличении толщины миофибрилл в 2 раза диффузия О2 обратно пропорциональна квадрату расстояния, которое О2 должен преодолеть в процессе диффузии. При этом необходимо учитывать, что количество капилляров в гипертрофированном миокарде остается неизменным.
Перераспределение кровотока. Происходит при выраженном падении МОК. В этой ситуации нейрорегуляторные механизмы обеспечивают необходимый уровень кровообращения в первую очередь для головного мозга, сердца и других жизненно важных органов.
Клеточные факторы обеспечивают компенсацию за счет изменения метаболизма, включения анаэробного обмена (в норме встречающегося только в поперечнополосатых мышцах), повышения утилизации О2, увеличения количества циркулирующих эритроцитов за счет мобилизации эритропоэза и т.д. Вместе с тем, необходимо учесть, что степень увеличения минутного объема не беспредельна. Вопросы регуляции нормальной деятельности сердца и проблемы компенсации ее нарушений всегда были в центре внимания физиологов и клиницистов, но до конца они не решены.
Известно, что минутный объем слагается из отдельных объемов, составляющих регионарный кровоток, а величина последних определяется местными и центральными механизмами. Не отрицая роли экстракардиальных механизмов в регуляции сердечной производительности, и в частности, центральной нервной системы, следует все же подчеркнуть, что сердце в определенной степени является саморегулирующейся системой. Подтверждением этому служит опыт пересадки донорского сердца, демонстрирующий сохранение адекватности кровообращения, несмотря на денервацию пересаженного органа.
В первую очередь МОК увеличивается за счет повышения ЧСС. Этот механизм обусловлен симпатической иннервацией и представляет собой наиболее оперативную адаптацию сердечного выброса, хотя и менее экономичную по сравнению с увеличением УОК. Последний также возрастает, но в меньшей степени. При увеличении ЧСС до 160 и более ударов в 1 мин происходит снижение сердечного выброса и МОК. С увеличением ЧСС почти в линейной зависимости растет общее ПО2, что при декомпенсации кровообращения или при выраженной гипертрофии желудочков крайне невыгодно и отрицательно сказывается на производительности сердца. Урежение ЧСС до 40 ударов в минуту, равно как и стойкая аритмия, также сопровождаются уменьшением МОК.
В норме изменения ЧСС при регуляции сердечного выброса находится в широких пределах – от 40 до 160 уд/мин. В условиях патологии рамки данного адаптационного механизма резко сужаются и даже незначительные отклонения ЧСС в ту или иную сторону (ниже 60 и выше 100 уд/мин) могут сопровождаться снижением МОК. Важно отметить, что у больных искусственное увеличение ЧСС не всегда приводит к повышению МОК.
В свете получающей все большее распространение теории об активном механизме диастолы приобретает особый интерес факт, согласно которому диастолическая податливость сердца (комплайнс) или его жесткость являются функцией ЧСС (Grossman et al., 1973). Таким образом, ритмодиастолическая зависимость выступает как важнейший механизм регуляции сердечного выброса.
По-видимому, физиологическое значение ритма не ограничивается только управлением МОК, а простирается на интеграцию всех сторон деятельности кардиореспираторной системы, обеспечивая единство функции составляющих ее структур. Управление величиной УОК осуществляется миогенной ауторегуляцией и экстракардиальным контролем. Факторами механизма ауторегуляции являются преднагрузка и постнагрузка.
Таким образом, величина ударного объема крови определяется следующими основными факторами:
- длиной мышечных волокон миокарда в конце диастолы (механизм Франка-Старлинга или преднагрузка);
- контрактильными возможностями миокарда (инотропизм);
- величиной сопротивления, преодолеваемого мышечными волокнами миокарда при его сокращении во время систолы (постнагрузка);
- временными и амплитудными характеристиками сердечного цикла.
Преднагрузка. В опытах на изолированной мышечной клетке, на отдельной мышце и на сердечно-легочном препарате было доказано, что сила сокращений саркомеров (миофибрилл) является функцией их первоначальной длины - иными словами, УОК прямо пропорционален диастолическому наполнению желудочков (Frank, 1895; Starling, 1918). Эту зависимость обозначают как длина - сила, а детерминирующий фактор - длину саркомера - понимают как функцию давления наполнения, или закон Франка–Старлинга. Механизм Франка–Старлинга служит в качестве миогенного гетерометрического регулятора сердечных сокращений, а описание его выражается такими переменными гемодинамики, как конечно-диастолический объем (КДО), конечно-диастолическое давление (КДД) и среднее давление в предсердии. Управление УОК сердца через механизм Франка–Старлинга – один из важнейших практических методов поддержания адекватного сердечного выброса. Механизм влияния преднагрузки тесно связан с гуморальными и нейрогенными механизмами ауторегуляции сердца. Построение функциональных кривых сердца, отражающих зависимость между УОК и КДО для оценки насосной функции, с успехом используют в клинической практике.
Постнагрузка. Постнагрузка представляет собой фактор другого механизма миогенной ауторегуляции УОК – гомеометрической регуляции, для реализации которой изменения исходной длины мышечного волокна или объема сердца не обязательны. Сущность этой регуляции, описываемой в виде зависимости давление - сила, проявляется в обратной связи УОК с постнагрузкой. Другими словами, при постоянстве диастолического объема увеличение постнагрузки приводит к уменьшению сердечного выброса.
Примечательно, что дать определение самой постнагрузке непросто. Некоторые авторы отождествляют постнагрузку со средним систолическим давлением в аорте (в легочной артерии для правого желудочка). На практике постнагрузку иногда оценивают по общему периферическому сопротивлению (ОПС), что объясняется неразработанностью теоретических основ этого вопроса. Ставить знак равенства между понятиями давление и сопротивление неправомерно. ОПС - характеристика стационарного движения жидкости, в то время как сердечно-сосудистая система функционирует в пульсирующем режиме. Еще К. Уиггерс (1929) указывал на недостаточную информативность данного показателя в отрыве от компонентов, его формирующих. Так, например, изменения СДД (среднединамического давления) и МОК, входящих в формулу определения ОПС  , могут взаимно нивелировать друг друга, оставляя показатель ОПС неизменным и тем самым снижая его информативность.
, могут взаимно нивелировать друг друга, оставляя показатель ОПС неизменным и тем самым снижая его информативность.
Развитием представлений о постнагрузке является предложение характеризовать ее с помощью импеданса – характеристики, описывающей механику жидкости при распространении в ней пульсовых волн давления и скорости (O'Rurk, Taylor, 1967). Однако исследования показали, что для более полноценного суждения о взаимодействии желудочка сердца с сосудистым руслом необходимы физиологические характеристики локальных изменений объема сосуда при прохождении пульсовых волн скорости и давления. Одной из таких характеристик является комплайнс или обратная ей величина - жесткость (Sunagawa et al., 1982). По-видимому, на современном этапе развития физиологии кровообращения дать приемлемое определение постнагрузке, удовлетворяющее как теоретиков, так и практиков, затруднительно. Поэтому для практики пока целесообразно относиться к термину «постнагрузка» как рабочему, подразумевающему совокупную динамическую характеристику взаимодействия желудочка сердца и фрагмента артериального (аортального) русла, принимающего порцию крови во время изгнания. Употребляемый в этом смысле термин «постнагрузка» допускает использование таких оценочных характеристик, как среднее артериальное давление, импеданс, комплайнс и многие другие, оставляя возможность дальнейшего уточнения содержания термина и его объема.
При увеличении сосудистого сопротивления повышается потребность миокарда в кислороде, что ухудшает контрактильность и вызывает депрессию МОК или, другими словами, снижение производительности сердца. Внешнее управление компонентами постнагрузки находит широкое применение в клинической практике.
Изменение инотропии сводится к изменению силы сердечных сокращений. Хотя данный эффект известен давно (его проявления описал еще в 80-е годы прошлого века И. П. Павлов), механизмы, объясняющие его, до конца не изучены.
Регуляция сердечно-сосудистой деятельности. Известно, что конечно-диастолический объем (КДО) желудочков формируется в момент окончания систолы предсердий, за которой после короткого (0, 005-0, 008 с) интерсистолического интервала начинается период напряжения желудочков. При этом в формировании КДО принимает участие кровь, поступающая из верхней и нижней полых вен через правое предсердие в правый желудочек и из легочных вен через левое предсердие в левый желудочек. Давлением заполнения при этом являются центральное венозное давление для правого желудочка и давление в легочных венах – для левого. По мере окончания периода диастазиса (он наиболее вариабелен, его продолжительность зависит от многих факторов, в том числе от частоты сердечных сокращений) начинается последний интервал периода диастолы – систола предсердий. В результате систолы предсердий в желудочки дополнительно нагнетается 15-20 % крови, после чего период наполнения желудочков заканчивается. Существуют дополнительные факторы, влияющие на формирование КДО, при этом общий объем крови и насосное действие скелетных мышц оказывают однонаправленное влияние, внутригрудное и внутриперикардиальное давление – разнонаправленное, а влияние положения тела в пространстве может быть различным. Тем не менее, основным препятствием, преодолеваемым потоком крови на этапе формирования КДО, является диастолическая растяжимость (комплайнс) желудочков, которая в свою очередь зависит от их механической жесткости. Нельзя также забывать, что в формировании КДО принимает участие кровь, оставшаяся в желудочках после предыдущего кардиоцикла.
Объем крови, изгоняемый желудочками во время каждого сокращения, представляет собой функцию укорочения волокон желудочков в период систолы. Механизм Франка-Старлинга, с помощью которого увеличение КДО и напряжения желудочков связано с увеличение силы сокращения, является главным источником компенсации сердечного выброса при недостаточности. Однако, как уже отмечалось ранее, было показано, что после растягивания сердечной мышцы за пределы, соответствующие вершине кривой «длина – активное напряжение», длина саркомера уже не увеличивается пропорционально длине мышцы. Поэтому механизм Франка-Старлинга можно рассматривать только как одну из первых линий обороны, призванных поддерживать нормальный минутный объем кровообращения при снижении сократимости миокарда. Роль же «венозного подпора» в целях мобилизации сократительной функции миокарда весьма ограничена.
Влияние дыхания на приток крови в сердце во время вдоха опосредуется через расширение грудной клетки и связанное с этим снижение давления в грудной полости. Кровь как бы «присасывается» из сосудов вне этой полости в вены, находящиеся внутри нее, и в сердце. Выдох, напротив, оказывает противоположное действие: повышение давления в грудной полости приводит к «сжатию» находящихся здесь сосудов, в итоге скорость поступления крови из вен, находящихся вне грудной полости, уменьшается.
Глубокий задержанный вдох, совершаемый при закрытой головой щели (проба Мюллера), приводит к снижению альвеолярного и внутриплеврального давления, а, следовательно, и к уменьшению давления в правом предсердии и в грудном отделе нижней полой вены. В брюшной полости давление при этом повышается за счет напряжения мышц брюшного пресса и опускания диафрагмы. Возникающий градиент давления передается в брюшной отдел нижней полой вены. В итоге за счет разности давлений происходит ускорение движения крови по направлению к сердцу. Однако такое ускорение весьма кратковременно, так как через некоторое время избыточное давление в брюшной полости приводит к сдавлению брюшного отдела нижней полой вены.
Проба Вальсальвы, при которой совершается усиленный выдох при закрытой голосовой щели и тем самым создается избыточное давление как в грудной, так и в брюшной полостях, вначале приводит к почти полному прекращению кровотока в тех участках крупных вен, где они входят в грудную и брюшную полости. Он не восстанавливается до тех пор, пока приток крови в эти вены из системы микрососудов не повысит давление в них до уровня, превышающего давление в венах, находящихся в грудной и брюшной полостях.
Тонус сосудов, оказывающий определяющее влияние на состояние транспортно-демпферной субсистемы кровообращения, зависит от импульсации, поступающей по афферентным путям от баро- и хеморецепторов, сосредоточенных преимущественно в каротидных синусах и дуге аорты. Барорецепторы находятся также в подключичных, щитовидных и мезентериальных артериях. Импульсы в ЦНС передаются от барорецепторов каротидных синусов по синусовому нерву (ветвь языкоглоточного нерва), а от аортальных барорецепторов - по левому аортальному нерву (ветвь блуждающего нерва). Эти нервы выполняют буферную роль, так как через них реализуется коррекция отклонений артериального давления. Пересечение или блокада их приводит к значительному повышению АД. Это свидетельствует о том, что они обеспечивают постоянное влияние, снижающее тонус сосудов.
Реализация рефлексов с барорецепторов в ЦНС ведет к снижению тонического влияния на сердце и сосуды симпатической иннервации. Сердечный компонент рефлекса реализуется через блуждающий нерв. В результате снижается АД как за счет расширения и за счет уменьшения миокардиальной активности.
Хеморецепторы воспринимают изменения газового состава крови и ее рН. Дыхательный ответ на их возбуждение более выразителен, чем сердечно-сосудистый. Хеморецепторы чувствительны к снижению напряжения О2 и к повышению СО2. Изолированная стимуляция хеморецепторов аортальной зоны вызывает тахикардию, повышение периферического сопротивления, значительное угнетение миокардиальной сократимости. Изолированная же стимуляция хеморецепторов каротидной зоны ведет к брадикардии с повышением сердечного выброса. Влияние хеморецептивных импульсов на кровообращение особенно отчетливо проявляется при большой кровопотере и гипоксемии. В том и другом случаях гипоксия этих рецепторов приводит к рефлекторному спазму артериол и увеличенному выделению катехоламинов, что направлено на повышение артериального давления.
Кровоснабжение тканей регулируется двумя механизмами. Один из них основан на регулирующем влиянии на тонус сосудов нервной системы. Это относится к сосудам, снабженным симпатическими волокнами. Просвет их меняется в зависимости от повышения или понижения тонуса симпатической иннервации. Второй механизм действует в основном в зоне микроциркуляции. Здесь просвет сосудов регулируется преимущественно действием на сосудистые стенки метаболитов, газов крови и ряда содержащихся в ней биологически активных веществ. Так, на уровне прекапиллярных сфинктеров выраженное сосудорасширяющее действие проявляет СО2. Еще большее действие в этом направлении свойственно гипоксии. К СО2 высокую чувствительность проявляют сосуды мозга, селезенки, а к уровню О2 чувствительны сосуды сердца и почек. Из биологически активных веществ на микрососуды наибольшее влияние оказывают катехоламины, гистамин, кинины, вазопрессин и молочная кислота.
Сопротивление кровотоку в различных отделах сосудистого русла неодинаково. Основное влияние на его уровень оказывает тонус артериол, метартериол, прекапиллярных сфинктеров. Важная роль принадлежит и венозному тонусу. От него зависит приток крови к сердцу и, соответственно, центральное венозное давление (ЦВД). Венозный тонус нарастает при повышении внутрилегочного давления, при сердечной недостаточности, увеличении РаСО2 (центральный эффект) и содержания катехоламинов в плазме крови. Повышение ЦВД за пределы 200 мм Н2О обычно свидетельствует о сердечной недостаточности.
Суммарный просвет сосудов возрастает от аорты к капиллярам. Общий просвет капилляров в 600-800 раз больше просвета аорты. Пропорционально этой разнице снижена в капиллярах и скорость кровотока. Но по направлению к сердцу она возрастает и в полых венах приближается к скорости в аорте. Движение крови в венах определяется силой проталкивания ее гидродинамическим эффектом, создаваемым левым желудочком сердца. Кроме того, оказывает влияние присасывающая сила дыхательных экскурсий груди, а также мышечная работа.
Кровообращение в малом круге имеет существенные особенности. Прежде всего это относится к кровяному давлению: оно составляет в легочной артерии лишь 1/6 давления в аорте. Причиной является более низкое, чем в аорте сопротивление кровотоку в легочных сосудах. В легких в норме содержится лишь 500 мл крови, из которой 20% - в капиллярах. Давление в сосудах легких повышается при гипоксии, ацидозе, хронических легочных заболеваниях, некоторых пороках сердца и в условиях повышенного внутриальвеолярного давления.
Для мозгового кровообращения существенной особенностью является то, что мозг, составляющий всего 2% массы тела, берет на себя 15 % минутного объема кровообращения, при этом на 100 г мозговой ткани приходится 45 мл крови в минуту. При некоторых состояниях указанная величина может возрастать в два раза. Кровеносные сосуды мозга не находятся под контролем вегетативной иннервации. На кровоснабжение мозга существенное влияние оказывает содержание СО2 в крови. При повышении РаСО2 на 1 мм ртутного столба мозговой кровоток увеличивается на 1 мл на 100 г мозговой ткани в минуту. Вдыхание 5 % СО2 повышает мозговой кротовок на 75%. Значительная гипервентиляция легких, приводящая к гипокапнии, снижает кровообращение мозга в соответствии с ее выраженностью. Так, снижение РаСО2 с 40 до 20 мм рт. ст. приводит к уменьшению кровотока в мозге более чем на 40%. При дальнейшем снижении РаСО2 на 10 мм рт. ст. кровоток еще уменьшается на 17%. К изменению напряжения кислорода кровоснабжение мозга менее чувствительно. Так, снижение РаО2 до 50 мм рт. ст. мало влияет на мозговой кровоток, но при РаО2=35 мм рт. ст. он удваивается.
Еще двумя факторами, определяющими состояние кровообращения, являются объем и реологические свойства циркулирующей крови. В физиологических условиях ОЦК составляет у мужчин 66 мл/кг, у женщин - 60 мл/кг. У людей с ожирением и в старческом возрасте ОЦК на 10% меньше. В среднем эта величина составляет около 7% от массы тела. Механизмы регуляции ОЦК также можно разделить на центральный и периферический. Центральная регуляция основана на афферентной импульсации с механо- и осморецепторов. Ответ на нее реализуется через гипоталамо-гипофизарно-адреналовую систему путем воздействия на кровяное депо и функцию почек. Периферический механизм регуляции ОЦК заключается в контроле распределения жидкости между внутрисосудистым и интерстициальным пространствами. В основе этого распределения лежит соотношение гидростатического и коллоидно-осмотического давлений крови в процессе движения ее по капилляру.
Основная часть ОЦК (80-85%) находится в сосудах низкого давления, к которым относятся вены большого круга и сосуды малого круга. Этот отдел сосудистой системы играет важную роль в реализации ею адаптивных реакций.
Сердечная недостаточность – патологическое состояние, при котором дисфункция миокарда приводит к неспособности сердца перекачивать тот объем крови, который необходим для удовлетворения метаболических потребностей организма, или же эти потребности обеспечиваются только за счет повышения давления наполнения желудочков. Она бывает левосторонней, правосторонней и тотальной (застойной). Левосторонняя сердечная недостаточность характеризуется застойными явлениями в легких, гипотонией и периферической вазоконстрикцией, приводящей к снижению перфузионного кровотока. Правосторонней сердечной недостаточности свойственны периферические отеки, асцит, повышение венозного давления. На практике сердечная недостаточность, как правило, бывает тотальной или с преобладанием дисфункции одной из сторон.
В зависимости от скорости развития симптомов сердечной недостаточности выделяют острую и хроническую ее формы. Хроническая недостаточность может протекать с эпизодами декомпенсации. В большинстве случаев сердечная недостаточность приводит к снижению сердечного выброса. Если же она возникает на фоне тиреотоксикоза, гиперфункции коры надпочечников, выраженной анемии и т.п., то сердечный выброс может быть высоким. Помимо классической (или систолической), встречаются случаи диастолической сердечной недостаточности. К последней, в частности, может приводить амилоидоз сердца, гипертрофическая кардиомиопатия и т.п.
В зависимости от выраженности клинических проявлений нарушенного кровообращения сердечная недостаточность может быть четырех функциональных классов (табл. 3.4).
Таблица 3.4
Классификация недостаточности кровообращения (Нью-Йоркская ассоциация кардиологов - NYHA)
| Функциональный класс | Определение | Терминология |
| I | Больные с заболеванием сердца, но без ограничений физической активности | Бессимптомная дисфункция левого желудочка |
| II | Больные с заболеванием сердца, вызывающим небольшое ограничение физической активности | Легкая сердечная недостаточность |
| III | Больные с заболеванием сердца, вызывающим значительное ограничение физической активности | Средней степени тяжести сердечная недостаточность |
| IV | Больные с заболеванием сердца, у которых выполнение даже минимальной физической нагрузки вызывает дискомфорт | Тяжелая сердечная недостаточность |
При сердечной недостаточности всегда имеет место снижение сократительной способности миокарда. Возникнуть оно может либо в результате первичного нарушения деятельности сердечной мышцы, либо под воздействием экстракардиальных причин (вторично).
Важно отличать истинную сердечную недостаточность от тех вариантов расстройств кровообращения, при которых нарушение функции миокарда не является определяющим (при тампонаде сердца, геморрагическом шоке, клинически значимой гиповолемии).
Истинная сердечная недостаточность всегда сопровождается абсолютным или относительным уменьшением полезной внешней работы, осуществляемой миокардом. Основной причиной снижения его сократительной способности являются расстройства энергетического обмена. Доказано, что угнетение АТФ-азной активности миозина и актомиозина приводит к нарушению распада аденозинтрифосфата, активирующего укорочение сократительных нитей саркомера. Следует также учесть возникающий при этом дисбаланс в сопряжении процессов возбуждения и сокращения в миофибриллах в результате изменения ультраструктуры самих сократительных белков (предположение о повреждении сократительных белков при недостаточности миокарда основано на снижении сократимости глицеринизированных миокардиальных волокон, выделенных из сердца больных тяжелыми формами острой сердечной недостаточности). Помимо этого происходит нарушение транспорта электронов в митохондриях, снижение общей массы митохондрий, разобщение процессов окисления и фосфорилирования.
Лечение сердечной недостаточности предусматривает использование комплексного подхода, направленного на улучшение насосной функции сердца, создание благоприятных условий для его работы, оптимизацию энергообеспеченности миокардиальных клеток. При выборе препаратов и их дозировок необходимо учитывать этиологию и генез сердечной недостаточности, а также ее выраженность. Наиболее частое применение находят β -адреномиметические средства (допамин и пр.), ингибиторы ангиотензин превращающего фермента, нитраты, β -адреноблокаторы, сердечные гликозиды, диуретики (см. гл. 47).
|
|