
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Первый закон термодинамики. Закон Гесса.
|
|
*Первое начало термодинамики — одно из основных положений термодинамики, являющееся, по существу, законом сохранения энергии в применении к термодинамическим процессам.
1)Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
2)Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе и не зависит от способа, которым осуществляется этот переход.
а) Внутренняя энергия изолированной системы постоянна. U=conts, dU=0
б) Все виды энергии переходят друг в друга в строго эквивалентных отношениях
δ Q=du+δ W - работа не является функцией состояния
Теплота, поддерживаемая в системе идет на увеличение внутренней энергии системы и на совершение системой работы δ - не ФС, d - ФС
δ W=pΔ V - Единственный вид механической работы которое рассматривает химическую термодинамику – это работа расширения против сил внешнего давления.
δ Q=dU+ pΔ V
1. Рассмотрим систему при V=const
V=const Δ V=0
δ Q=dU+ (pΔ V)=0; δ Q=dU dU - теплоте, V=const
В системе при V=const теплота приобретает свойства функции состояния Qv- ФС
2. При p=const
dQ = dU+pdV; DQ = DU+pdV
DQ = Q2-Q1 + pV2-pV1 = (U2+pV2)-(U1+pV1) = H2-H1=DH. H=U+pV
Из этого выражения видно, что теплота при постоянном давлении приобретает свойства ФС. Таким образом, если химическая реакция протекает при постоянном
объеме или давлении, то теплота, которая выделяется или поглощается при протекании реакции является ФС
Рассмотрим несколько случаев:
4. Если δ Q > 0, то это означает, что тепло к системе подводится.
5. Если δ Q < 0, аналогично — тепло отводится.
6. Если δ Q = 0, то систему называют адиабатически изолированной.
Обобщая: в конечном процессе 1→ 2 элементарные количества теплоты могут быть любого знака. Общее количество теплоты, которое мы назвали просто Q — это алгебраическая сумма количеств теплоты, сообщаемых на всех участках этого процесса. В ходе процесса теплота может поступать в систему или уходить из неё разными способами.
Первое начало термодинамики:
а) при изобарном процессе
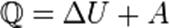
б) при изохорном процессе (A=0)

в) при изотермическом процессе (Δ U = 0)

Закон Гесса.
Основной закон термохимии, который формулируется следующим образом:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы).

Следствия из закона Гесса
**Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
**Тепловой эффект химической реакции равен разности сумм теплот образования (Δ Hf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):

**Тепловой эффект химической реакции равен разности сумм теплот сгорания (Δ Hc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):

Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т.н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры.
|
|