
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химические свойства газов.
|
|
Основная масса перевозимых газов – это углеводороды и аммиак.
Углеводороды делятся на 2 группы: 1) те, которые добываются из чисто газовых месторождений, так называемые натуральные газы, состоящие в основном из метана, но имеющие примеси этана, азота, углекислоты, водяного пара. 2) вторая группа – так называемые нефтяные или попутные газы – получают при добычи нефти или в процессе ее перегонки, это в основном пропан и бутан.
Углеводородные газы используются в основном как промышленное и бытовое топливо и как сырье для химической промышленности.
Свойства углеводородов, особенно химические, зависят от строения их молекул.
Предельные, насыщенные углеводороды или алканы – это углеводороды у которых все валентные связи заполнены, т.е. определяются формулой Сn H2n+2.
Это метан СН4, этан С2Н6, пропан С3Н8, бутан С4Н10.
                Н
Н - С - Н
Н
метан Н
Н - С - Н
Н
метан
| Н Н Н Н-С-С-С-Н Н Н Н пропан | Н Н Н Н Н-С-С-С-С-Н Н-Н-Н-Н бутан нормальный |
Это стабильные, не вступающие в реакции друг с другом без цвета и запаха газы. Все предельные углеводороды горят с образованием оксида углерода и воды:
CH4+2O2=CO2+2H2O+880 дж.
С увеличением молекулярных масс предельных углеводородов повышается их температура плавления и кипения. Так, при числе атомов углерода от 5 до 17 – это уже жидкости, с еще большим числом атомов углерода – твердые тела.
Изомерия – явление, при котором могут существовать несколько веществ, имеющих один и тот же состав, одну и ту же молекулярную массу, но различающихся строением молекул. Например, нормальный бутан имеет температуру кипения при атмосферном давлении –0, 5°С,


 Н Н Н
Н Н Н
а изо-бутан Н-С-С-С-Н -11, 7°С
 | |||||
 |  | ||||
Н Н
 Н-С-Н
Н-С-Н
Н
Чем больше атомов углерода, тем больше может быть изомеров: у пентана – 3, а у декана (С10Н22) уже -75.
Непредельные (ненасыщенные) углеводороды или алкены – это углеводороды, имеющие между атомами углерода двойные связи.
СnH2n – одна двойная связь – этиленовый ряд
Этилен С2Н4
СnH2n-2 – диеновый ряд – 2 двойные связи.
Н Н Н Н
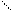



С=С-С=С - бутадиен
 |  |
Н Н
Характерные реакции непредельных углеводородов: присоединения, окисления, полимеризации.
Углеводороды практически не растворимы в воде, но могут образовывать гидраты – вещества, похожие на измельченный лед. Гидраты могут забивать фильтры, дроссельные клапана, отрицательно сказываются на работе насосов. Ингибиторами могут служить метанол, этанол, Однако применять их можно только по согласованию с грузополучателем, т.к. даже небольшое количество их может отрицательно влиять на качество груза (например этилена), растворять ингибиторы полимеризующихся грузов.
Полимеризация – это химический процесс, при котором мономеры (одинаковые или различные) присоединяются друг к другу без выделения каких-либо побочных продуктов реакции, т.е. из низкомолекулярных веществ (мономеров) образуются высокомолекулярные, так называемые макромолекулы. Естественные полимеры – это крахмал, смолы, целлюлоза; искусственные – смолы, лаки, пластмассы и т.п.
Пример: винилхлорид




 Н Cl H Cl Cl
Н Cl H Cl Cl

 C=C ® H-C-C-C=C ® (- CH2-CHCl-)n + тепло
C=C ® H-C-C-C=C ® (- CH2-CHCl-)n + тепло



 полимер
полимер
H H H H H H
Мономер димер
Также подвержены полимеризации бутадиен, изопрен, этиленоксид и др.
На спонтанную полимеризацию влияют: тепло, кислород, другие загрязнения.
Ингибиторы – вещества, предотвращающие или замедляющие реакции полимеризации. Ингибиторы хорошо растворяются в воде, антифризах. Они токсичны.
|
|