
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Сформулируйте принцип Паули.
|
|
В одном атоме не может существовать более одного электрона с одинаковым набором четырех квантовых чисел. z(n,  , m,
, m,  )=0 или 1.
)=0 или 1.
17.. В чем суть правила отбора для магнитного квантового числа?
m=0, ±1, ±2, …, ± l (l – орбитальное квантовое число).
18.Чему равно максимальное число электронов находящихся в состояниях  ?
?
n=2, l =1. Максимальное количество электронов равно 8.
19..В чем суть правила отбора для орбитального квантового числа?
l=0, 1, 2, …, n-1. (n – главное квантовое число).
20.Если состояние электрона обозначаются символами 2s и 2р, то чему равны их главные и орбитальные квантовые числа?
2s – n=2, l =0; 2p – n=2, l =1. n – главное квантовое число; l – орбитальное квантовое число.
21. Какие квантовые числа характеризуют размер и форму электронного облака?
Главное квантовое число характеризует размер электронного облака, орбитальное – форму.
22. Электрон находится в состоянии, определяемом волновой функцией  .Найти модуль вектора орбитального момента импульса этого электрона.
.Найти модуль вектора орбитального момента импульса этого электрона.
l =0, (орбитальное квантовое число).
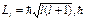 – постоянная Планка, l – орбитальное квантовое число, l=0, 1, 2, …, n-1. (n – главное квантовое число).
– постоянная Планка, l – орбитальное квантовое число, l=0, 1, 2, …, n-1. (n – главное квантовое число).

23..Электрон находится в состоянии, определяемом орбитальным квантовым числом  Чему равен модуль вектора его орбитального момента?
Чему равен модуль вектора его орбитального момента?
l =2, (орбитальное квантовое число).
 – постоянная Планка, l – орбитальное квантовое число, l=0, 1, 2, …, n-1. (n – главное квантовое число).
– постоянная Планка, l – орбитальное квантовое число, l=0, 1, 2, …, n-1. (n – главное квантовое число).

24 .Состояние электрона определяется волновой функцией  .Чему равна величина вектора орбитального момента импульса электрона?
.Чему равна величина вектора орбитального момента импульса электрона?
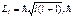 – постоянная Планка, l – орбитальное квантовое число, l=0, 1, 2, …, n-1. (n – главное квантовое число).
– постоянная Планка, l – орбитальное квантовое число, l=0, 1, 2, …, n-1. (n – главное квантовое число).
l= 1, 
25. Состояние электрона определяется волновой функцией  .Чему равна проекция вектора орбитального момента импульса электрона?
.Чему равна проекция вектора орбитального момента импульса электрона?
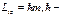 постоянная Планка, m – магнитное квантовое число, m=0, ±1, ±2, …, ± l (l – орбитальное квантовое число).
постоянная Планка, m – магнитное квантовое число, m=0, ±1, ±2, …, ± l (l – орбитальное квантовое число).
m= 0. 
26.Запишите возможные значения орбитального квантового числа l и магнитного квантового числа ml для квантового числа n = 4.
при n=4
L=0, 1, 2, 3
M=0, ±1, ±2, ±3, ±l
27.Чему равно максимальное значение проекции полного момента импульса на ось Z для L – электронов?
l=1, L=mħ, mmax=l, L=1* ħ
28.Чему равно максимальное значение проекции полного момента импульса на ось Z для M – электронов?
l=2, M=mħ, mmax=l, m=2 ħ
29.Чему равно максимальное значение проекции полного момента импульса на ось Z для N– электронов?
l=3, N=mħ, mmax=l, m=3 ħ
30.Какие квантовые числа имеет внешний (валентный) электрон в основном состоянии атома натрия (калия)?
Распределение электронов в атоме по оболочкам определяют его электронную конфигурацию. Для указания электронной конфигурации атома пишут в ряд символы заполнения электронных состояний оболочек nl, начиная с самой близкой к ядру. Индексом справа вверху отмечают числа электронов в оболочке, находящихся в этих состояниях. Например, у атома натрия 2311Na, где Z=11 - порядковый номер элемента в таблице Менделеева; число электронов в атоме; число протонов в ядре; A=23 - массовое число (число протонов и нейтронов в ядре). Электронная конфигурация имеет вид: 1s2 2s2 2p6 3s1, т.е. в слое с n=1 и l=0 - два s-электрона; в слое с n=2 и l=0 - два s-электрона; в слое с n=2 и l=1 - шесть р-электронов; в слое с n=3 и l=0 - один s-электрон.
31.Определите, во сколько раз орбитальный момент импульса электрона Li, находящегося в f -состоянии, больше, чем для электрона в
|
|