
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Фибриллообразующие коллагены (I, II, II, V, XI типы) и их биогенез.
|
|
Формирование коллагеновых волокон осуществляется во внеклеточном пространстве из отдельных молекул тропоколлагена. Биосинтез тропоколлагена уникален, поэтому некоторые его стадии реализуются не в клетках, а в межклеточном матриксе. Синтез коллагена осуществляется в основном фибробластами и родственными им клетками (хондробластами, остеобластами, одонтобластами), в меньшей степени – эпителиальными и гладкомышечными клетками и некоторыми другими. Синтез и созревание (посттрансляционная модификация) коллагена достаточно сложна и имеют клеточные и внеклеточные этапы.
Клеточный этап. Начинается синтез a-цепей на рибосомах в виде предшественника, который несколько длинней и имеет добавочные последовательности на N- и С-концах. Каждая разновидность предшественника a-цепи имеет специфическую моноцистронную информационную РНК. Синтезируемый предшественник a-цепи не содержит ни гидроксипролина, ни гидроксилизина. Образуются они путем окисления кислот, уже присутствующих в полипептидной цепи. Эта модификация (гидроксилирование) осуществляется параллельно с трансляцией под действием монооксигеназ, сопряженных с окислением a-кетокислот: лизил-гидроксилазы и пролил-гидроксилазы (пролил-4- и пролил-3-гидроксилазы). Это ферменты со смешанной функцией, связанные с микросомами, содержащие в структуре Fe2+ (восстановленно).

остаток пролина в цепи α -кетоглутаровая кислота
про-α -коллагена

остаток 4-гидроксипролина янтарная кислота
в цепи про-α -коллагена
В ходе ферментативного процесса a-кетоглутарат подвергается окислительному декарбоксилированию до янтарной кислоты, один атом кислорода включается в оксипролин, другой – в янтарную кислоту, а замещаемый атом водорода остатка пролина освобождается в виде протона. Аскорбиновая кислота (витамин С) служит в качестве восстанавливающего агента для поддержания железа фермента в двухвалентном состоянии. Установлено также, что аскорбиновая кислота стимулирует биосинтез пролил-гидроксилаз в клетках, усиливая экспрессию соответствующего гена.
Сходная оксигеназа, лизил-гидроксилаза, функционирующая при участии тех же кофакторов, гидроксилирует в проколлагене некоторые остатки лизина в 5-м положении.
Гидроксилированию подвергаются не все остатки пролина и лизина, имеющиеся в составе a-цепи, а лишь специфические, определяемые последовательностью аминокислот. В большинстве a-цепей гидроксилируется не более 0, 6% остатков от общего аминокислотного состава, а, например, в a1(V)-цепи в гидроксипролин превращается каждый четвертый из 180 остатков пролина, на долю 5-гидроксилизина приходится 1, 5% от общего аминокислотного состава.
При развитии авитаминоза и гиповитаминоза С происходит снижение гидроксилирования пролина и лизина в составе проколлагена с последующим нарушением созревания и образования полноценного, зрелого коллагена.

остаток лизина в
цепи про-α -коллагена

остаток 5-гидроксилизина в янтарная кислота
цепи про-α -коллагена
В процессе образования полипептидной цепи в клетках осуществляется и другая постсинтетическая модификация белковой структуры – N-гликозилирование радикалов аспарагина под действием специфических гликозилтрансфераз. Как правило, a-цепь содержит 1 и 2 олигосахаридных фрагмента и лишь в некоторых их число достигает 6-8. В коллагене капсулы хрусталика (тип IV) – 110. В коллагенах типа I и III осуществляется D-гликозилирование 5-гидроксилизина. При этом в костной ткани к коллагену присоединяется обычно галактоза, а дермы - a-глюкозидо(1, 2)-галактоза.
После завершения синтеза полипептидной цепи процессы гидроксилирования и гликозилирования прекращаются, происходит отщепление сигнального пептида и образуется про-a-цепь, способная образовать тройную суперспираль коллагеновой молекулы. С N-конца про-a-цепи в коллагенах I-IV и XI типов имеется N-концевой пропептид, состоящий менее, чем из 160 аминокислотных остатков. С-концевые пропептиды содержатся только в предшественниках фибриллярных коллагенов (I, II, III, V и XI типы), длиной около 250 аминокислотных остатков, среди которых находятся 7-8 радикалов цистеина. Эти дополнительные N-концевые и С-концевые пептиды способствуют правильной укладке про-a-цепей коллагена в трехцепочечную суперспираль. При этом происходит объединение N-концов всех трех про-a-цепей, между С-концевыми пропептидами трех цепей возникают дисульфидные мостики. Концевые пропептиды не образуют тройную спираль, а формируют глобулярные домены. Суперспирализация охватывает только центральную часть молекулы проколлагена, которые попадают в секреторные пузырьки (везикулы), образующиеся в аппарате Гольджи, а затем выделяются в межклеточную среду, где подвергаются дальнейшим превращениям.
Внеклеточный этап биогенеза коллагена представляет собой четыре последовательных превращения. Во-первых, это отщепление пропептидов N-концевыми и С-концевыми протеиназами, которые выделяются во внеклеточный матрикс фиборбластами и родственными им клетками. В результате проколлаген превращается в почти готовый тропоколлаген, молекулы которого способны к самоорганизации в надмолекулярные волокнистые структуры. На концах молекул этих проколлагенов, как правило, сохраняются неспирализованные участки (N- и С-телопептиды). Они у основных фибриллярных коллагенов невелики, состоят из 9-35 аминокислотных остатков и специфичны для отдельных типов коллагенов, что позволяет использовать определение их содержания как маркеров интенсивности обмена коллагена. У минорных типов коллагена (V и XI) телопептиды значительно крупнее.
Во второй стадии (неферментативной) осуществляется самосборка коллагеновых волокон. В разных тканях эта стадия протекает по-разному, но всегда начинается с формирования коллагеновой микрофибриллы. В фибриллярных коллагенах большое количество молекул тропоколлагена уложены в одну линию: начало каждой молекулы (N-конец) направлено к С-концу предшествующей. Однако в местах сближения эти молекулы не связаны между собой и между С- и N-концами соседних молекул, сохраняется промежуток в 35 нм. Такое расположение молекул тропоколлагена поддерживается слабыми, многократно повторяющимися взаимодействиями «бок о бок» соседними линейными укладками, которые смещены почти на четверть длины каждой молекулы. Монотонность смещения соседних молекул тропоколлагена относительно друг друга связана с тем, что места сосредоточения заряженных радикалов остатков аминокислот вдоль тройной суперспирали чередуется с участками скопления незаряженных гидрофобных радикалов. Периодичность чередования составляет около 67 нм. Длина молекулы тропоколлагена фибриллярного типа составляет 300 нм, то расчет показывает:
(67 ´ 5) – 300 = 35 нм. (Рис. 8).

Рисунок 8. Схема строения коллагеновой микрофибриллы. [И.Г. Щербак, 2005]

Рисунок 9. Схема биогенеза коллагена. [Е.С. Северин, 2005]
При образовании микрофибрилл объединяются от 20 до 100 параллельных рядов, каждый протяженностью в десятки молекул тропоколлагена. В целом микрофибрилла имеет форму стержня (прутка) толщиной 30-50 нм и длиной несколько микрометров. Микрофибриллы, в свою очередь, организуются в более крупные структуры - коллагеновые фибриллы. Коллагеновые фибриллы в сухожилиях уложены в продольные пучки толщиной в несколько микрометров – коллагеновые волокна (рис. 9). В костях и роговице глаза коллагеновые фибриллы располодены послойно, кодга параллельные ряды их в одном слое направлены под углом (чаще перпендикулярно) волокнам соседнего слоя. В коже и тканях легких укладка фибрилл напоминает нити в плетеных изделиях (чулки, носки), вследствие чего обеспечивается устойчивость к растяжению и нагрузкам в разных направлениях.
Таким образом, во внеклеточном пространстве в результате ступенчатой самосборки образуются мощные фибриллярные структуры.
Дальнейшие стадии внеклеточного преобразования коллагена подключаются по мере течения очередной стадии, не дожидаясь полного завершения всего процесса в целом. Они направлены на повышение устойчивости, прочности коллагена на механические воздействия.
В третьей стадии происходит окислительное дезаминирование части лизильных и 5-гидроксилизильных радикалов, которые располагаются в основном в концевых телопептидах. Данная реакция осуществляется медьсодержащей лизилоксидазой, в результате e-NН2 группа окисляется в альдегидную:

Остаток лизина Остаток аллизина
в цепи α -коллагена в цепи α -коллагена
В четвертой стадии происходит формирование ковалетных связей между молекулами тропоколлагена. Остатки аллизина и гидроксиаллизина спонтанно взаимодействуют с радикалами лизина, а также друг с другом в составе разных молекул тропоколлагена, образуя поперечные связи (сшивки) в виде альдиминов (шиффовые основания) и альдолей (рис. 10).
Однако соединения, имеющие в своей структуре двойные связи, все же оказываются не очень устойчивыми. Стабилизация этих структур осуществляется путем восстановления альдиминов или посредством внутримолекулярной перестройки с «перемещением» двойной связи из цепи в состав кетогруппы. При этом образуются своеобразные диаминодикарбоновые кислоты – лизинонорлейцин, гидроксилизинонорлейцин, лизино-5-кетонорлейцин и гидроксилизино-5-кетонорлейцин. В результате соседние молекулы тропоколлагена оказываются соединенными ковалентной связью поперечной бифункциональной сшивки, обладающей высокой прочностью и определенной гибкостью. Поперечные сшивки имеют упорядоченное расположение: как правило, каждый концевой телопептид соединен сшивкой с расположенным на том же уровне участком суперспирали смежной молекулы тропоколлагена.


Рисунок 10. Схема образования бифункциональных сшивок между молекулами тропоколлагена.


Количество поперечных связей в фибриллах коллагена зависит от функции и возраста ткани. Так, особенно много сшивок в сухожилиях и связках, поскольку для этих структур важна прочность. С возрастом количество сшивок в фибриллах коллагена возрастает, что приводит к замедлению его метаболизма у пожилых и старых людей. При снижении активности лизилоксидазы, а также при недостатке меди или витаминов РР и В6 нарушается образование поперечных сшивок и вследствие этого снижается прочность и упругость коллагеновых волокон. Кожа, сухожилия, кровеносные сосуды и др. становятся хрупкими, легко разрываются.
По мере созревания коллагена появляются связи и перемычки между отдельными микрофибриллами. При этом происходит спонтанное взаимодействие кетоиминной сшивки, уже имеющейся в одной микрофибрилле, с альдегидным радикалом, расположенным в другой микрофибрилле в ее телопептидной части. Как результат, образуется пиридиниевое кольцо, которое связывает три разные молекулы тропоколлагена. Образуется трифункциональная сшивка. В образовании подобных трифункциональных сшивок чаще всего участвует 5-гидроксиаллизил, и при его взаимодействии с гидроксилизино-5-кетонорлейцином образуется гетероцикл – гидроксилизил-пиридинолин (рис. 11).Гидроксилизил-пиридинолин преобладает в коллагенах большинства тканей, включая сухожилия и хрящ. В коллагене минерализуемых тканей (дентин, кость) число подобных пиридиниевых сшивок значительно меньше (меньше в 5-10 раз), чем в хряще, и они представлены лизил-пиридинолином или дезоксипиридинолином (продукт взаимодействия 5-гидроксиаллизила с лизино-5-кетонорлейцином). Когда вместо 5-гидроксиаллизила с кетоиминной бифункциональной сшивкой реагирует аллизил, образуется трифункциональная сшивка пиррольного типа (рис. 12).
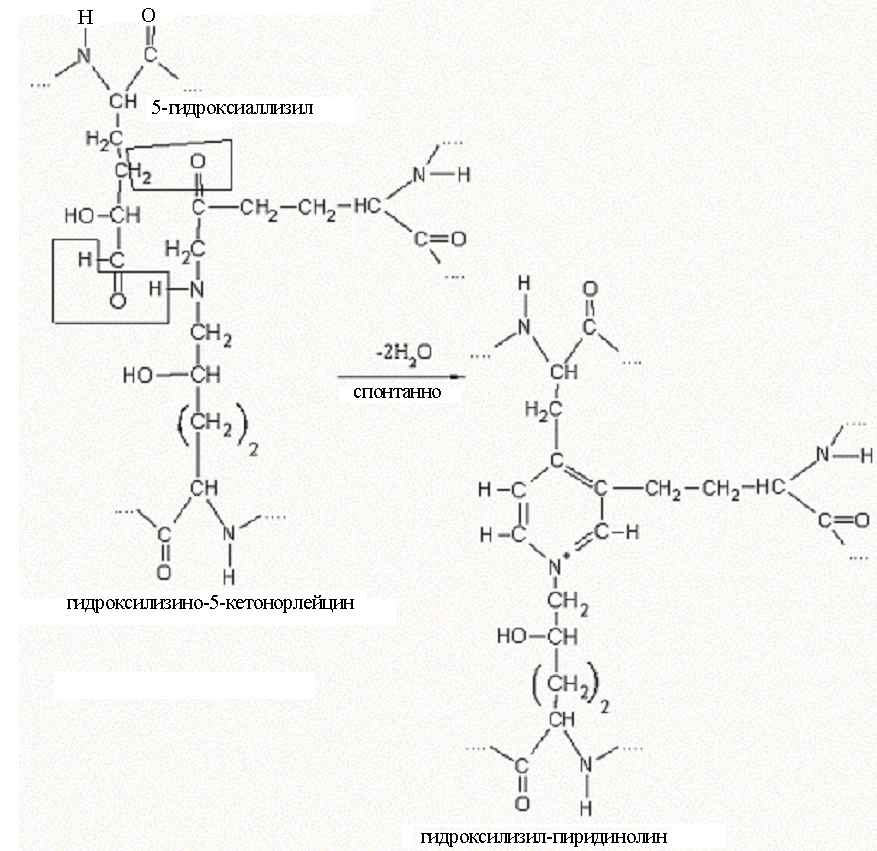
Рисунок 11. Схема образования трифункциональных сшивок в коллагеновых волокнах (пиридинолин).


Рисунок 12. Схема образования трифункциональных сшивок в коллагеновых волокнах (дезоксипиридинолин, пиррол).
Коллагены, ассоциированные с фибриллами (IX, XII, XIV, XV, XVI и XVIII типы). Эти типы коллагена ограничивают размер фибрилл, образуемых интерстициальными коллагенами (особенно I и II типов), а также участвуют в организации межклеточного матрикса в костях, коже, хрящах, сухожилиях. Сами они фибрилл не формируют, но непосредственно взаимодействуют с фибриллами зрелого коллагена. Так, наиболее распространенный коллаген IX типа состоит из трех «коллагеновых» (фибриллярных) доменов и четырех «неколлагеновых» (глобулярных) структур (рис. 13).

Рисунок 13. Схема структуры коллагена IX типа. (КОЛ1 и т.д. – фибриллярные домены, НК1 и др. – глобулярные структуры).
Коллаген IX типа связан с фибриллами коллагена II типа в хряще поперечными лизин-аллизиновыми мостиками в области доменов КОЛ1 и КОЛ2, а также НК1, НК2 и НК3. Он присоединяется к коллагену II типа антипараллельно с периодичностью 67 нм (рис. 14). НК имеет значительное число остатков диаминомонокарбоновых аминокислот, заряжен поэтому положительно. С ним хорошо взаимодействуют отрицательно заряженные гликозаминогликаны (гиалуроновая кислота, хондроитинсульфаты), что имеет важное значение для участия коллагена IX типа в организации межклеточного матрикса в хрящевой ткани.
Аналогично, с фибриллами коллагена I типа, преобладающего в костях, ассоциирован коллаген – XII.

Рисунок 14. Схема структур коллагена II типа и ассоциированного с ним коллагена IX типа [Е.С. Северин, 2003]
Коллагены, образующие сетеподобные структуры (IV, VI, VII, VIII и X типы). Эти коллагены значительно отличаются от коллагенов, формирующих параллельные ряды волокон. Их молекулы не могут ассоциироваться латерально с образованием фибрилл, N- и С-концевые пропептиды у них не отщепляются и именно эти фрагменты участвуют в образовании олигомерных форм за счет формирования дисульфидных мостиков и поперечных лизиновых связей. Почти у всех коллагенов этого класса неспирализованные концы молекул имеют очень большие размеры, а спирализованные участки либо значительно длиннее обычного (коллагены IV, VII типов), либо в 2-3 раза короче (коллагены – VI, VIII, X).
Наиболее изученными являются коллагены IV и VIII типов. Коллаген–IV являются основным структурным компонентом базальных мембран, являющихся особой формой межклеточного матрикса. Его секретируют различные клетки: эпителиальные, эндотелиальные, мышечные, нервные, жировые. Неспирализованные концы молекулы коллагена-IV имеют центры (от 3 до 8) связывания с клетками и другими белками. Коллаген-IV формирует специфическую сетчатую структуру с гексогональными ячейками размером около 170 нм, расположенных в одной плоскости (рис. 15). Между параллельными плоскостями отдельных сетей также появляются гидролизино-5-кетонорлейциновые связи, что приводит к образованию обширного пласта многослойной сети. Контакты между элементами подобной основы базальной мембраны подкрепляются другим белком - ламинином – гликопротеином, способным взаимодействовать с коллагеном типа IV и клеточными рецепторами.

Рисунок 15. Организация коллагена IV типа. [Е.С. Северин, 2003]
А. Тройная спираль мономера коллагена: 7S – N-конец; НК1 – С-конец.
Б. Полимеризация коллагена IV типа: 1- мономер, 2- димеры, образованные соединением мономеров в области НК1-доменов; 3- тетрамеры, образованные соединением мономеров в области 7S-сегментовв параллельном и антипараллельном направлениях; 4-образование сетчатой структуры из олигомерных форм коллагена IV типа.
Коллаген X специфичен для минерализуемых участков хрящевой ткани. Имеет короткоцепочную структуру, состоящую из короткого коллагенового домена (1/2 структуры) и N- и С-глобулярных фрагментов. Он также как коллаген IV, формирует сетчатую структуру. Коллаген –VIII тоже относится к короткоцепочным. Это главный компонент десцеметовых мембран эндотелия роговицы, где образует гексогональные решетки, обеспечивающие прозрачность роговицы. Коллаген типа VIII присутствует во многих тканях, а также составляет основу матрикса под эндотелиальными клетками кровеносных сосудов. Короткоцепочным белком является и коллаген VI типа, он образует микрофибриллы, которые располагаются между крупными фибриллами интерстециальных коллагенов. Он содержится в хрящевой ткани, но особенно много его в межпозвоночных дисках, составляя более 20% общего коллагена. Две молекулы этого коллагена соединяются антипараллельно с образованием вначале димера, затем тетрамера. Тетрамеры секретируются во внеклеточное пространство и связываются «конец в конец» с образованием микрофибрилл (рис. 16). Микрофибриллы могут связываться со многими компонентами межклеточного матрикса, в частности с фибриллами интерстециальных коллагенов, гиалуровновой кислотой, протеогликанами и, возможно, адгезивными молекулами (интегринами).

Рисунок 16. Организация коллагена VI типа. [Е.С. Северин, 2003]
1- мономер; 2- димер; 3- тетрамер, соединенный полностью; 4- тетрамер, соединенный частично; 5- микрофибриллы, соединенные «конец в конец».
Более изучены в этом отношении коллагены типа VII и XVII, которые формируют якорные (заякоренные) фибриллы, связывающие клетки эпителия с субэпителиальными слоями. Так, каждая молекула коллагена-VII содержит два неколлагеновых домена и один коллагеновый домен между ними (рис. 17). Из мономеров образуются димеры, соединяясь антипараллельно в области N-концов молекул (НК2 домена). Затем НК2 домены отщепляются и димеры, взаимодействуя гидрофобными участками, образуют фибриллы. Своими неспирализованными концами (НК1 домены) фибриллы закрепляются на lamina densa (плотной пластинке) базальной мембраны эпителия, взаимодействия с коллагеном типа IV, а средняя часть (коллагеновый домен) выступает в виде петли в подлежащий слой, сквозь которую проходят фибриллы ретикулярной пластинки, образуемые коллагенами I и III. Коллаген XVII типа представляет собой трансмембранный белок и находится в гемидесмисомах эпидермиса. Таким образом, коллагены типа VII и XVII участвуют в процессе присоединения эпидермиса к дерме.

Рисунок 17. Организация коллагена VII типа. 1- мономер коллагена VII типа, НК1 и НК2 – неколлагеновые домены у С- и N-конца; 2- димер коллагена VII типа, молекулы собраны антипараллельно с перекрытиями на N-конце; 3- димеры коллагена VII типа после удаления НК2-доменов; 4- фибрилла, образованная доменами коллагена VII типа, соединенными «бок о бок».
Распад коллагена. Коллаген - относительно медленно обменивающийся белок и Т1/2 (период полужизни) его составляет недели и месяцы. Разрушение коллагена осуществляется активными формами кислорода и протеиназами. Основную роль играют металлопротеиназы, способные расщеплять коллаген. Это цинк-содержащие эндопептиды, активные при нейтральных значениях рН и вырабатываемые многими клетками – от фибробластов и макрофагов до эндотелиальных и тучных клеток. Выделено 15 матриксных металлопротеиназ (ММП), которые различаются по спектру субстратной специфичности, а также по особенностям строения и типу клеток, которые их синтезируют. Их старые названия – коллагеназы, желатиназы, стромелизин, матрлизин, металлоэластаза употребляются редко. Коллагеназы получили обозначение ММП-1, ММП-8, ММП-13, а желатиназы – ММП-2 и ММП-9.
Так, ММП-1 расщепляет коллагены типа I, II, III, VII, VIII, X, а ММП-2 – коллагены типа I, IV, V, VII, X, XI, ММП-8 – коллагены типа I, II, III, V, VII, VIII, X и т.д. Однако скорость гидролиза разных коллагенов одним и тем же энзимом может различаться очень сильно. Металлопротеиназы в значительной степени дублируют друг друга. Многие из них расщепляют не только компоненты волокнистых структур матрикса, но и другие белки основного вещества. Наиболее универсальны в этом отношении ММП-2, ММП-7 и особенно ММП-3, которые способны расщеплять большинство белков внеклеточного матрикса.
Базальный уровень биосинтеза матриксных металлопротеаз очень низок. ММП также практически не хранятся в специализированных секреторных гранулах. В основном регуляция функцтонирования ММП реализуется: а) индукцией на уровне транскрипции; б) активацией проферментов и в) угнетением эндогенными ингибиторами протеиназ. Транскрипцию индуцируют ряд цитокинов, в частности, интерлейкин-1, фактор рекроза опухоли, тромбоцитарный фактор роста – бета и др.
ММП выделяются в матрикс в форме неактивных предшественников. Их N-концевой пропептид содержит радикал цистеина, взаимодействующий с атомом цинка в каталитическом центре. Отщепление пропептида деблокирует Zn и переводит энзим в активную форму. Многие из ММП осуществляют активацию друг друга. Активаторами также являются плазмин, калликреин, катепсин В.
Угрозу избыточной деградации компонентов внеклеточного матрикса предотвращают ингибиторы протеиназ. Это небольшие белки, выделяемые клетками в окружающую среду. Наиболее важную роль играют ингибиторы активаторов плазминогена и тканевые ингибиторы металлопротеиназ (ТИМП). ТИМП специфически угнетают активный центр металлопротеиназ, благодаря тому, что содержат по 12 остатков цистеина, блокирующие атом Zn2+ в активном центре. Из четырех известных ингибиторов семейства этих белков наиболее активные ТИМП-1 и ТИМП-2, способные блокировать активность различных ММП, а также некоторые другие протеолитические белки. В защите от избыточного протеолиза во внеклеточной среде участвуют и плазменные ингибиторы протеиназ: a1-антитрипсин, a2-макроглобулин, a1-антихимотрипсин. Обеспечивая контролируемый протеолиз, внеклеточные протеиназы играют ведущую роль в обновлении коллагена, а также других белковых компонентов внеклеточного матрикса. Коллагеназы расщепляют тройную спираль тропоколлагена, чаще между остатками глицина и лейцина (изолейцина) примерно на 1/4 длины молекулы с С-конца. Образующиеся фрагменты коллагена растворимы в воде, при температуре тела они денатурируют и становятся доступными действию других протеолитических ферментов.
Некоторые микроорганизмы синтезируют высокоактивную коллагеназу, разрушают соединительно-тканные барьеры и обеспечивают себе инвазию или проникновение в организм.
В результате распада коллагена в крови и моче человека появляется свободный гидроксипролин. Часть ее выводится с мочой, а большая доля этой иминокислоты катаболизируется под влиянием гидроксипролиноксидазы. Тем не менее, гидроксипролин является маркерной кислотой, уровень которой в крови и моче позволяет судить о скорости (интенсивности) распада коллагена в организме. При этом необходимо иметь в виду, что около 50% всех коллагеновых белков содержится в тканях скелета, около 40% - в коже, 10% - в строме внутренних органов.
Другим распространенным белком, относящимся к фибриллярным, в соединительных структурах является эластин.
Эластин – второй главный белок соединительной ткани. Эластин преобладает в желтой соединительной ткани. В желтой затылочной связке содержание эластина примерно в 5 раз больше, чем коллагена, а ахилловом сухожилии человека коллагена содержится примерно в 20 раз больше, чем эластина. В коже объемная часть эластина составляет лишь 3-4% фибриллярных структур. Однако, эластина много в стенках больших кровеносных сосудов, стенках бронхов, в легочной ткани, некоторых связках. Этот белок обладает резиноподобными свойствами: растягивается в несколько раз по сравнению с исходным, возвращается в первоначальное состояние после снятия нагрузки. Белок обладает высокой прочностью на разрыв, не образует при кипячении желатину, как коллаген. Резиноподобные свойства эластина обусловлены особенностями его состава и строения.
Нативные волокна эластина построены из относительно небольших почти сферических молекул гликопротеина, получивших название тропоэластин и соединенных в волокнистые тяжи с помощью жестких поперечных сшивок. Молекула проэластина с молекулярной массой около 70000 Да состоит из более, чем 700 аминокислотных остатков с преобладанием глицина, валина, аланина. В них отсутствуют триптофан, метионин, гистидин. Таким образом, в структуре эластина привалируют аминокислоты с неполярными радикалами, чередование которых легче формируют b-повороты полипептидной цепи, чем a-спирали.
b-спирализации также свойственна упругая гибкость и растяжимость. В целом более, чем половине молекулы тропоэластина присуща b-спиральная структура и лишь 10% - a-спирализация. Между обширными гидрофобными участниками цепи тропоэластина присутствуют остатки лизина, имеющие важное значение. В большинстве своем остатки лизина под действием внеклеточной лизилоксидазы окисляются до аллизина или 5-гидроксиаллизина. За счет взаимодействия радикала лизина одной молекулы тропоэластина и аллизина другой молекулы белка формируются бифункциональные лизино-норлейциновые сшивки, как между молекулами тропоколлагена. Однако, в эластине образуются и совершенно другие связи, уникальные и присущие

Рисунок 18. Схема формирования десмозина при согревании эластина. (Изодесмозин отличается наличием боковой цепочки в положении 2, а не 4).
только эластину. Это тетрафункциональная сшивка, в формировании которой участвуют радикал 5-гидроксиаллизина, двух радикалов аллизина и одного радикала лизина из разных молекул тропоэластина. Основу этой структуры составляет пиридиниевое кольцо (как и в коллагенах), но от кольца отходят не три, а четыре цепочки белковых молекул (рис. 18). Такая структура получила название десмозин. Имеется и его изомер – изодесмозин, отличающийся расположением одной полипептидной цепи в кольцевой структуре. Образование и сочетание двух типов описанных связей в зрелом эластине позволяет формировать ветвящиеся волокнистые структуры, анастомозирующих между собой. Величина ячеек эластиновой сети значительно варьирует, но подобная организация зрелого (полимеризованного) эластина обеспечивает прочность и упругую эластичность (пружинистость) при растяжении в любом направлении.
Эластин синтезируется в виде тропоэластина фибринобластами, хондроцитами, гладкомышечными клетками. Формирование эластических волокон осуществляется во внеклеточном матриксе.
Эластические волокна внеклеточного матрикса формируются в основном в развивающихся тканях и почти не синтезируются у взрослых. Зрелый эластин ассоциируется с коллагеновыми волокнами и другими структурами внеклеточного матрикса с участием специальных гликопротеинов – фибриллина; гликопротеина, ассоциированного с микрофибриллами; фибуллина.
Эластин характеризуется нерастворимостью, высокой стабильностью и низкой скоростью обмена. Катаболизм эластина происходит при участии матриксных металлопротеиназ (ММП). Эластин с различной скоростью расщепляют ММП-2, ММП-3, ММП-7, ММП-9, ММП-10, ММП-12 и ММП-14. Наиболее эффектна среди них ММП-12 или металлоэластаза, которую продуцируют макрофаги. Эластин расщепляется также эластазой, вырабатываемой нейтрофилами. Она относится к другому семейству протеиназ – сериновым ферментам. Эластаза нейтрофилов гидролизует не только эластин, но и другие структурные белки межклеточного матрикса. Ее основным ингибитором является a1-антитрипсин (a-антипротеиназа).
|
|