
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Расчет изменения энергии Гиббса в химических реакциях.
|
|
Протекание любой химической реакции в изобарно-изотермической условиях определяется двумя факторами. Первый фактор – энтальпийный ( ) – определяет изменение энергии системы. Второй фактор – энтропийный (
) – определяет изменение энергии системы. Второй фактор – энтропийный ( ) – определяет изменение неупорядоченности системы. Таким образом, протеканию химической реакции способствует уменьшение энергии системы и переход ее в более неупорядоченное состояние.
) – определяет изменение неупорядоченности системы. Таким образом, протеканию химической реакции способствует уменьшение энергии системы и переход ее в более неупорядоченное состояние.
Энергия Гиббса связана с энтальпией и энтропией:  . В любой закрытой системе при постоянном давлении и температуре возможен такой самопроизвольный процесс, который ведет к уменьшению энергии Гиббса. Следовательно, условием принципиальной возможности протекания химической реакции является неравенство:
. В любой закрытой системе при постоянном давлении и температуре возможен такой самопроизвольный процесс, который ведет к уменьшению энергии Гиббса. Следовательно, условием принципиальной возможности протекания химической реакции является неравенство:  . В случае, когда
. В случае, когда  , самопроизвольное протекание реакции невозможно. Если
, самопроизвольное протекание реакции невозможно. Если  , система находится в состоянии химического равновесия.
, система находится в состоянии химического равновесия.
Вклады энтропийного и энтальпийного факторов значительно зависит от температуры. При 
 и
и  .
.
Доминирующим становиться энтальпийный фактор, поэтому при низких температурах, как правило, протекают самопроизвольно экзотермические реакции.
При 
 и
и  .
.
Доминирующим становится энтропийный фактор, поэтому при высоких температурах, как правило, самопроизвольно протекают реакции, ведущие к увеличению энтропии.
Таким образом, при анализе возможности самопроизвольного протекания химической реакции необходим одновременный учет энтальпийного и энтропийного факторов.
Изменение энергии Гиббса в ходе химической реакции можно рассчитать как разность между суммой стандартных энергий Гиббса образования продуктов реакции и суммой стандартных энергий Гиббса образования исходных веществ:
 , (2.45)
, (2.45)
где ν – стехиометрические коэффициенты, с которыми исходные вещества и продукты реакции входят в термохимическое уравнение реакции.
Следует помнить, что стандартная энергия Гиббса образования простых веществ, находящихся в наиболее устойчивом в стандартных условиях фазовом состоянии, равна нулю.
Таблица 1. Оценка возможности протекания химической реакции.
| Знак изменения функции. | Возможность протекания химической реакции. | Пример химической реакции. | ||
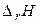
| 
| 
| ||
| – < 0 | + > 0 | – < 0 | Реакция возможна в любом интервале температур. | 
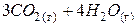
|
| + < 0 | – < 0 | + > 0 | Реакция невозможна в любом интервале температур. | 
|
| – < 0 | – < 0 |  > 0
< 0
> 0
< 0
| Реакция возможна лишь при низких температурах, когда  . .
| 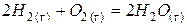
|
| + > 0 | + > 0 |  > 0
< 0
> 0
< 0
| Реакция возможна лишь при высоких температурах, когда  . .
| 
|
|
|