
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Водородные соединения кремния, методы получения и свойства. Силициды металлов. Соединения с галогенами, их получение и свойства; гидролиз.
|
|
Силаны (кремневодороды, гидриды кремния) — соединения кремния с водородом общей формулы SinH2n+2.
Наиболее распространённый способ получения — разложение кислотами силицидов металлов. Например, силицида магния:

Для синтеза моносилана используют разложение триэтоксисилана в присутствии натрия, при t=80 °C:
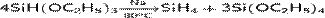 ,
,
либо реакцией алюмогидрида лития с тетрахлоридом кремния:

По физическим свойствам силаны сходны с углеводородами. Моносилан SiH4 и дисилан Si2Н6 являются бесцветными газами с неприятным запахом, трисилан Si3Н8 — бесцветная, ядовитая, летучая жидкость. Высшие члены гомологического ряда — твёрдые вещества. Силаны растворяются в этаноле, бензине, органосиланах, CS2. Силаны, бораны и алканы имеют одинаковые формулы, но разные свойства. Силаны воспламеняются на воздухе, Si2Н6 взрывается при контакте с воздухом. Наиболее термически устойчивым является моносилан (энергия связи Si—H 364 кДж/моль)
Силаны чрезвычайно легко окисляются. Моносилан в присутствии кислорода окисляется со вспышкой даже при температуре жидкого воздуха. В зависимости от условий реакции, продуктом окисления является либо SiO2, либо промежуточные вещества:
 Δ Ho298 = –1357 кДж
Δ Ho298 = –1357 кДж
Силаны являются хорошими восстановителями, они переводят КМnО4 в MnO2, Hg(II) в Hg(I), Fe(III) в Fe(II) и т. д. Силаны устойчивы в нейтральной и кислой средах, но легко гидролизуются даже в присутствии малейших следов ОН− -ионов:


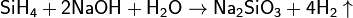
Реакция протекает количественно и может использоваться для количественного определения силана. Под действием щелочи возможно также расщепление связи Si—Si:

С галогенами силаны реагируют со взрывом, при низких температурах образуются галогениды кремния.
Критическая точка моносилана достигается примерно при –4 °C и давлении 50 атм.
Силици́ ды — соединения кремния с менее электроотрицательными элементами (как правило, металлами). Силициды известны для щелочных и щелочноземельных металлов, большей части d-металлов и f-металлов. Be, Ag, Au, Zn, Cd, Hg и все p-элементы силицидов не образуют.
Металлоподобные силициды обладают электропроводностью, а некоторые высшие силициды являются полупроводниками. Ряд силицидов, например, V3Si, при низких температурах обладают сверхпроводимостью. Силициды s- и d-элементов обладают слабыми парамагнитными или диамагнитными свойствами. V3Si, Cr3Si, Mo3Si — антиферромагнетики, силициды редкоземельных элементов — ферро- или антиферромагнетики.
Силициды щелочных металлов бурно, со взрывом, реагируют с водой с выделением силанов, легко окисляются кислородом воздуха. Силицид магния Mg2Si не реагирует с водой и растворами щелочей, но взаимодействует с растворами кислот. Силициды щелочноземельных металлов также разлагаются водой, растворами кислот и щелочей.
Лантаноиды образуют силициды различного состава, устойчивы к действию кислорода до температуры ~500°C, сравнительно устойчивы к действию воды - окисляются только при долгом кипячении с выделением силанов и водорода. Аналогичные соединения актиноидов легче окисляются на воздухе, но более устойчивы к действию воды и кислот.
Силициды переходных металлов тугоплавки и стойки к окислению ввиду образования оксидных (металла или кремния) плёнок.
Силициды получают прямым синтезом при спекании металла с кремнием или реакцией кремния с расплавом металла.

Взаимодействием кремния с гидридами металлов
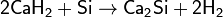
Взаимодействием избытка металла на оксид кремния(IV)

В технической физике и автоматике используется силицид ванадия V3Si как сверхпроводник, силицид рения ReSi как полупроводник. Многие силициды входят в состав жаростойких материалов, например дисилицид молибдена MoSi2. Большое практическое значение имеет ферросилиций.
Некоторые силициды редкоземельных элементов используются как высокотемпературные поглотители нейтронов в атомной промышленности.
Кремния галогениды, соединения кремния с галогенами. Известны кремния галогениды следующих типов (Х-галоген): SiX4, SiHnX4-n (галогенсиланы), SinX2n+2 и смешанные галогениды, например SiClBr3. При обычных условиях SiF4 - газ, SiCl4 и SiBr4 - жидкости (tпл - 68, 8 и 5°С), SiI4 - твёрдое тело (tnл 124°С). Соединения SiX4 легко подвергаются гидролизу:
SiX4 +2H2O=SiO2 +4HX;
на воздухе дымят вследствие образования очень мелких частиц SiO2; тетрафторид кремния реагирует иначе:
SiF4 +2H2O=SiO2 +2H2SiF6
Хлорсиланы (SiHnX4-n), например SiHCl3 (получается действием газообразного HCl на Si), при действии воды образуют полимерные соединения с прочной силоксановой цепью Si-O-Si. Отличаясь большой реакционной способностью, хлорсиланы служат исходными веществами для получения кремнийорганических соединений. Соединения типа SinX2n+2, содержащие цепи атомов Si, при Х - хлор, дают ряд, включая Si6Cl14 (tnл 320°С); остальные галогены образуют только Si2X6. Получены соединения типов (SiX2)n и (SiX)n. Молекулы SiX2 и SiX существуют при высокой температуре в виде газа и при резком охлаждении (жидким азотом) образуют твёрдые полимерные вещества, нерастворимые в обычных органических растворителях.
Тетрахлорид кремния SiCl4 используется при производстве смазочных масел, электроизоляций, теплоносителей, гидрофобизирующих жидкостей и т. д. кремний силикат кварц кристалл.
|
|