
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Общая характеристика солей алюминия, их растворимость, гидролиз. Квасцы. Алюмосиликаты. Применение алюминия и его соединений.
|
|
Из гидроксида алюминия можно получить практически все соли алюминия. Почти все соли алюминия хорошо растворимы в воде; плохо растворяется в воде фосфат алюминия.
В растворе соли алюминия показывают кислую реакцию. Примером может служить обратимое воздействие с водой хлорида алюминия:
Аl(ОН)3+3НСl«AlCl3+3Н2O
Практическое значение имеют многие соли алюминия. Так, например, безводный хлорид алюминия АlСl3 используется в химической практике в качестве катализатора при переработке нефти, а также при получении толуола по реакции Фриделя-Крафтса. В качестве катализаторов используются и другие галогениды алюминия.
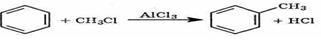
Соли алюминия и сильных кислот хорошо растворимы в воде и подвергаются в значительной степени гидролизу по катиону, создавая сильнокислотную среду, в которой растворяются такие металлы, как магний и цинк. Нерастворимы в воде фторид AlF3 и ортофосфат АlРO4.
Широко используются двойные соли алюминия — квасцы KAl(SO4)2•12H2O, NaAl(SO4)2•12H2O, NH4Al(SO4)2•12H2O и др. — обладают сильными вяжущими свойствами и применяются при дублении кожи, а также в медицинской практике как кровоостанавливающее средство.
Алюмосиликаты — группа природных и синтетических силикатов, комплексные анионы которых содержат кремний и алюминий.
Алюмосиликаты не растворимы в воде, разлагаются фтористоводородной кислотой, расплавами щелочей и карбонатами щелочных металлов. Некоторые алюмосиликаты медленно взаимодействуют с СО2 и водой, подвергаясь в природных условиях выветриванию с образованием кварца и других минералов.
Природные алюмосиликаты, не содержащие группы (OH) и кристаллической воды, являются тугоплавкими, термически стойкими соединениями.
Синтетические алюмосиликаты получают гидротермальным синтезом при нагреве оксидов кремния SiO2 и алюминия Al2O3 с оксидами металлов.
Алюминий используется для получения алюминиевых сплавов. Чистый алюминий – конструкционный материал в строительстве, применяется в электротехнике, является раскислителем чугуна и стали, восстановителем оксидов в производстве металлов методом алюмотермии. Применяется в качестве компонента твердых ракетных топлив, пиротехнических составов и взрывчатых веществ. В виде пудры и пасты применяется в качестве лакокрасочных материалов.
Оксид алюминия применяется в качестве огнеупорного и абразивного материала, для производства керамических резцов и электротехнической керамики. Монокристаллы используются в качестве лазерного материала, камней часовых механизмов и ювелирных камней. Алюмогель является адсорбентом при осушке газов и жидкостей, используется в хроматографии, применяется как носитель катализаторов.
Гидроксид алюминия используется при производстве соединений алюминия, компонент зубных паст, применяется в медицине.
Хлорид алюминия применяется в качестве катализатора в органическом синтезе, для очистки сточных вод и обработки дерева.
Сульфат алюминия – коагулянт для обработки питьевых и промышленных вод, применяется при производстве бумаги и в текстильной промышленности.
|
|