
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Механизм действия. Механизм действия этих дегидрогеназ до конца не установлен
|
|
Механизм действия этих дегидрогеназ до конца не установлен. Использование меченых 2Н-спиртов и изучение их окисления под действием дегидрогеназ NAD показало, что дегидрогеназы катализируют прямой перенос к NAD+ водорода, который связан с углеродом спиртовой группы. Многие наблюдения позволяют рассматривать процесс биологического окисления, т. е. дегидрирование, как удаление гидрид-иона (Н–) вместе с протоном (Н+), а не удаление двух атомов водорода. Водород, присоединенный к кислороду спирта, высвобождается в реакционную среду в виде протона (Н+).

Таким образом, NAD+ и NADP+ можно рассматривать как коферменты, акцептирующие гидрид-ион.
NAD+ и NADP+ представляют собой коферменты большого числа дегидрогеназ. Они принимают участие в переносе электронов в ходе окислительно-восстановительных реакций. Обычно символически реакцию окисления с участием дегидрогеназ обозначают ± 2Н. Это означает, что происходит перенос двух электронов и двух протонов (Н+) в виде гидрид-иона (Н–) и протона (Н+), т. е. необходимо помнить, что при переносе двух атомов водорода речь идет о переносе двух протонов и двух электронов.
В присутствии восстановленного субстрата АН2 — донора электронов и соответствующей дегидрогеназы пиридиновое кольцо кофермента восстанавливается путем связывания в 4-м положении одного протона и двух электронов; второй протон отщепляется в реакционную среду. Поэтому NAD+ и NADP+ являются акцепторами электронов, хотя на самом деле переносится гидрид-ион водорода (Н–). В обратной реакции NADH + H+ и NADPH + H+ выступают в роли донора электронов (рис. 10): действуют в качестве кофермента в реакции ферментативного дегидрирования (на рисунке изображена никотинамидная часть молекулы NAD+ или NADP+, остальная ее часть обозначена буквой R).
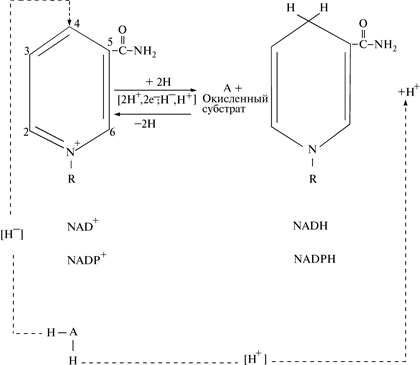
Рис. 10. Прямая и обратная реакция переноса протонов водорода (электронов) в NAD+ или NADP+
Участие пиридинуклеотидов в качестве окислителей или восстановителей в реакциях, катализируемых оксидоредуктазами, показано на рис. 11. Функциональной частью этих соединений является никотинамидное кольцо. Окисленные формы NAD+ и NADP+ несут положительный заряд, который обычно изображают локализованным на атоме азота никотинамидного кольца. Однако в результате резонанса внутри кольцевой системы пиридина можно предположить существование трех структур, различающихся локализацией положительного заряда. Одна из структур несет положительный заряд при атоме углерода С—4 (хотя может и при С—2 и С—1). Анаэробные дегидрогеназы катализирует перенос атома водорода вместе со связанными с ним электронами в виде гидрид-иона (Н–) от молекулы субстрата (АН2) к положительно заряженному атому С—4 NAD+, образуя в результате восстановленную форму кофермента NADH + H+. Электронная пара гидрид-иона водорода (Н–) становится связующей парой вновь образовавшейся ковалентной связи между атомом углерода С—4 и атомом водорода Н. Субстрат, теряющий гидрид-ион от одного из своих атомов, становится положительно заряженным ионом, который стабилизируется, отдавая протон в окружающую водную среду. В обратной реакции оксидоредуктаза катализирует перенос гидрид-иона от С—4 NADPH на протонируемый субстрат.
Таким образом, NADP+ и NADРН различаются наличием или отсутствием одного гидрид-иона, который эквивалентен двум электронам и одному протону (Н+). Именно поэтому анаэробные дегидрогеназы относят к переносчикам водорода и двухэлектронным окислительно-восстановительным ферментам.

Рис. 11. Участие пиридиннуклеотидов в реакциях переноса протонов водорода (электронов) в качестве коферментов дегидрогеназ
Аэробные дегидрогеназы могут передавать отнятый водород непосредственно кислороду воздуха. Коферментами этих дегидрогеназ являются FMN и FAD (флавинмононуклеотид и флавинадениндинуклеотид).
Аэробные дегидрогеназы или флавиновые ферменты принимают участие в терминальной цепи переноса электронов в организме животных и растениях.
Простетической группой этих ферментов являются флавинмононуклеотид (FMN) и флавинадениндинуклеотид (FAD). В состав FMN входит азотистое основание диметилизоаллоксазин, вместо сахара рибозы — спирт рибит и фосфорная кислота. В состав FAD входит FMN, соединенный с другим нуклеотидом, содержащим азотистое основание — аденин, сахар—рибозу и фосфорную кислоту. Простетическая группа флавопротеинов содержит рибофлавин — это диметилизоалаксазин соединенный со спиртом рибитом (витамин В2)(рис. 12).

Рис. 12. Строение молекулы FMN и FAD
Коферментом флавопротеинов в большинстве случаев служит FAD, реже — FMN. Эти коферменты функционируют в качестве прочно связанных с белками—ферментами простетических групп. Это их отличает от NAD+ и NADP+, которые могут существовать в клетке в свободном виде, диффундируя от одного белка-фермента к другому. В катализируемых флавопротеинами реакциях изоаллоксазиновое кольцо служит промежуточным переносчиком водорода, отщепляемого в ходе окислительно-восстановительной реакции.
Термин «флавинадениндинуклеотид» (FAD) не совсем правомерен, так как D -рибитальная группа не образует с рибофлавином гликозидной связи и, следовательно, данная молекула не является динуклеотидом. Флавинмононуклеотид (FMN) также не является нуклеотидом, но оба эти термина прочно вошли в биохимическую терминологию.
Реакции гидрирования и дегидрирования с участием флавиновых дегидрогеназ, исходя из концепции переноса гидрид-иона Н–, можно представить в следующем виде (рис. 13).

Рис. 13. Прямая и обратная реакции переноса протонов водорода
(электронов) в FAD
В этой реакции гидрид-ион Н– присоединяется в 5-е положение, а протон Н+ — в первое.
В структуры некоторых флавиновых ферментов встроены ионы металлов. Это металлофлавиновые ферменты. Окисленные формы флавиновых ферментов связывают ионы металлов трудно, но все же они образуют окрашенные в красный цвет комплексы с Ag+ и Cu+.
|
|