
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Уравнение адсорбции Гиббса
|
|
Выше (п. 2.4) мы пришли к выводу, что процесс адсорбции обусловлен снижением поверхностного натяжения. Очевидно, чем в большей степени ПАВ снижает поверхностное натяжение, тем большей должна быть его адсорбция. Напротив, ПИВ должна быть присуща отрицательная адсорбция.
Исходя из второго закона термодинамики американский ученый Дж. Гиббс в 70 – х гг. XIX в. вывел важное уравнение, связывающее величину адсорбции со способностью растворенного вещества изменять поверхностное натяжение раствора:
 (3.1)
(3.1)
где Гi, – избыточная адсорбция i-го компонента (см. 2.10), ci – его молярная концентрация в растворе, Т – температура, при которой происходит адсорбция, R – газовая постоянная,  – изменение поверхностного натяжения раствора при изменении концентрации на dci.
– изменение поверхностного натяжения раствора при изменении концентрации на dci.
В такой форме уравнение Гиббса применяется для разбавленных растворов. Вы, очевидно, помните, что для концентрированных растворов концентрацию нужно заменить активностью:
 (3.2)
(3.2)
Уравнение Гиббса было выведено теоретически. В дальнейшем оно было подтверждено экспериментально Мак – Беном методом среза тонких слоев с последующим их химическим анализом. Аналогичные исследования были проведены Сазаки с использованием метода радиоактивных индикаторов.
Проанализируем уравнение Гиббса.
Если  < 0, то Гi > 0, т. е. наблюдается положительная избыточная адсорбция – i – е вещество концентрируется на поверхности раствора; если
< 0, то Гi > 0, т. е. наблюдается положительная избыточная адсорбция – i – е вещество концентрируется на поверхности раствора; если  > 0, то Гi < 0, т. е. наблюдается отрицательная избыточная адсорбция – i – е вещество уходит с поверхности в объем раствора.
> 0, то Гi < 0, т. е. наблюдается отрицательная избыточная адсорбция – i – е вещество уходит с поверхности в объем раствора.
Для того чтобы рассчитать Гi по уравнению адсорбции Гиббса, надо знать  , т. е. производную поверхностного натяжения от концентрации i-го компонента. Из математики известно, что производная – это тангенс угла наклона касательной, проведенной к данной точке. Следовательно, имея зависимость
, т. е. производную поверхностного натяжения от концентрации i-го компонента. Из математики известно, что производная – это тангенс угла наклона касательной, проведенной к данной точке. Следовательно, имея зависимость 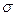 от с (рис. 3.2), можно определить значение
от с (рис. 3.2), можно определить значение  (при концентрации сi касательная в точке 1).
(при концентрации сi касательная в точке 1).

отсюда
 (3.3)
(3.3)
Точно так же можно рассчитать значение избыточной адсорбции для любой концентрации и заполнить таблицу (табл. 3.1.).
Данные, приведенные в таблице, позволяют построить изотерму адсорбции [Гi = f(сi)], общий вид которой представлен на рис. 3.3. По мере увеличения концентрации адсорбция возрастает вначале резко, затем все медленнее, асимптотически приближаясь к некоторой величине, называемой предельной адсорбцией  . Существование предельного значения адсорбции понятно, так как поверхность раствора имеет определенную площадь и при достижении определенной концентрации ПАВ в растворе (
. Существование предельного значения адсорбции понятно, так как поверхность раствора имеет определенную площадь и при достижении определенной концентрации ПАВ в растворе ( ) она оказывается полностью занятой молекулами ПАВ. Поскольку адсорбция мономолекулярна (т. е. однослойна) дальнейшее увеличение концентрации ПАВ в растворе ничего не может изменить в поверхностном слое.
) она оказывается полностью занятой молекулами ПАВ. Поскольку адсорбция мономолекулярна (т. е. однослойна) дальнейшее увеличение концентрации ПАВ в растворе ничего не может изменить в поверхностном слое.
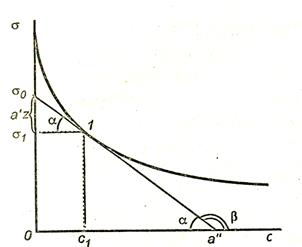
Рис. 3.2. Определение избыточной адсорбции

Рис. 3.3. Изотерма адсорбции
Таблица 3.1
Значение избыточной адсорбции для любой концентрации
| сi | 
| Zi | Гi | сi | 
| Zi | Гi |
| c1 | 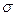 1 1
| Z1 | Г1 | c4 | 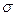 4 4
| Z4 | Г4 |
| c2 | 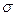 2 2
| Z2 | Г2 | … | … | … | … |
| c3 | 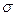 3 3
| Z3 | Г3 | … | … | … | … |
|
|