
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Квантование энергии электрона в атоме
|
|
Некоторые физические величины, относящиеся к микрообъектам, изменяются не непрерывно, а скачкообразно. О величинах, которые могут принимать только вполне определенные, то есть дискретные значения (латинское " дискретус" означает разделенный, прерывистый), говорят, что они квантуются.
В 1900 г. немецкий физик М. Планк, изучавший тепловое излучение твердых тел, пришел к выводу, что электромагнитное излучение испускается в виде отдельных порций - квантов - энергии. Значение одного кванта энергии равно
Δ E = h ν,
где Δ E - энергия кванта, Дж; ν - частота, с-1; h - постоянная Планка (одна из фундаментальных постоянных природы), равная 6, 626·10− 34 Дж·с.
Кванты энергии впоследствии назвали фотонами.
Идея о квантовании энергии позволила объяснить происхождение линейчатых атомных спектров, состоящих из набора линий, объединенных в серии.
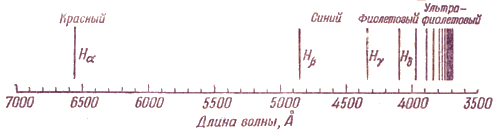
Еще в 1885 г. швейцарский физик и математик И.Я. Бальмер установил, что длины волн, соответствующие определенным линиям в спектре атомов водорода, можно выразить как ряд целых чисел. Предложенное им уравнение, позднее модифицированное шведским физиком Ю.Р. Ридбергом, имеет вид:
1 / λ = R (1 / n 12 − 1 / n 22),
где λ - длина волны, см; R - постоянная Ридберга для атома водорода, равная 1, 097373·105 см− 1, n 1 и n 2 - целые числа, причем n 1 < n 2.
Первая квантовая теория строения атома была предложена Н. Бором. Он считал, что в изолированном атоме электроны двигаются по круговым стационарным орбитам, находясь на которых, они не излучают и не поглощают энергию. Каждой такой орбите отвечает дискретное значение энергии.
Переход электрона из одного стационарного состояния в другое сопровождается излучением кванта электромагнитного излучения, частота которого равна
ν = Δ E / h,
где Δ E - разность энергий начального и конечного состояний электрона, h - постоянная Планка.

Дискретность энергии электрона является важнейшим принципом квантовой механики. Электроны в атоме могут иметь лишь строго определенные значения энергии. Им разрешен переход с одного уровня энергии на другой, а промежуточные состояния запрещены.
Третий постулат Н. Бора определяет правила квантования стационарных орбит. Бор предположил, что момент импульса электрона, вращающегося на стационарной орбите в атоме водорода, может принимать только дискретные значения, кратные постоянной Планка. Для круговых орбит правило квантования Бора записывается в виде:

|
где me – масса электрона, υ – его орбитальная скорость, rn – радиус n-ой стационарной орбиты. Целое число n называется квантовым числом.
Правило квантования орбит по Бору получило наглядную интерпретацию в теории де Бройля, высказавшего гипотезу о наличии у электрона волновых свойств (1924 г.). Согласно де Бройлю электрону (и любому другому микрообъекту) соответствует волновой процесс с длиной волны

|
где p – импульс электрона.
В применении к орбитальному движению электрона на стационарной круговой орбите в атоме водорода из правила квантования Бора вытекает соотношение
| nλ = 2π rn. |
Это означает, что длина волны де Бройля целое число раз укладывается на длине стационарной круговой орбиты электрона, то есть стационарная орбита соответствует круговой стоячей волне де Бройля на длине орбиты.
Бо́ ровская моде́ ль а́ тома (Моде́ ль Бо́ ра) — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать энергию непрерывно и очень быстро и, потеряв её, упасть на ядро. Чтобы преодолеть эту проблему, Бор ввёл допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определённым (стационарным) орбитам, находясь на которых они не излучают, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причём, стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка.
|
|