
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Решение
|
|
Решение
1. Кг(СН3СООNH4)=Kw/(Kb*Ka)=10-14/((1, 8*10-5)2)=3.1*10-5
α =  =0, 56%
=0, 56%
2. СН+= 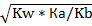 =10-7моль/л
=10-7моль/л
3. рН=7
2. Какой объем 0, 1 н HNO2 можно приготовить и 0, 7 л раствора азотной кислоты с массовой долей 30% при плотности раствора 1, 18 кг/л?
Решение
1. Найдем количество эквивалентов кислоты, содержашейся в 0, 7 л:
nэ=700*1, 18*0, 3/63=3, 93 экв
2. V(0, 1 н раствора)=nэ/0, 1=39, 3 л
3.В состав крови входит буферная система, состоящая из двух анионов. Приведите формулы её составных частей. Назовите эту буферную систему. Классифицируйте её по составу и природе компонентов. Укажите зону буферного действия. Напишите уравнения реакций, отражающих механизм действия (ионная форма).
Ответ
1. Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемоглобиновая. Из этих систем только фосфатная состоит из двух анионов: Н2РО4– (донор протонов) и НРО42– (акцептор протонов). Фосфатная буферная система составляет всего лишь 1% от буферной емкости крови. В других тканях эта система является одной из основных.
2. Роль кислоты в этой системе выполняет однозамещенный фосфат NaH2PO4, а роль соли двузамещенный фосфат – Na2HPO4.
3. Зона буферного действия буферной пары (Н2РО4––НРО42–)находится в интервале от 6, 2 до 8, 2.
4. Буферное действие фосфатной системы основано на возможности связывания водородных ионов ионами НРО42– с образованием Н2РО4–:
Н+ + НРО42– —> Н2РО4–, а также ионов ОН– с ионами Н2РО4–:
ОН– + Н2РО4– —> HPO42–+ H2O.
_____________________________________________________________________________
4.Рассчитайте ионную силу раствора, полученного при смешивании равных объемов водных растворов (по 500 мл) хлорида калия, фосфата натрия, если.исходная концентрация всех двух растворов составляла 0, 04 моль/л
Решение
1. В растворе — 4 вида ионов: К+, Cl-, РО43-, Na+.
Концентрации каждого из ионов в исходных растворах, в соответствии со стехиометрией диссоциации, равны: С(К+)= С(Cl-)=С(Na+)= 0, 04 моль/л, С(РО43-)=0, 12 моль/л
2.После смешения растворов общий объем увеличился вдвое, так как, согласно условию, смешали два раствора. Поскольку хлорид калия и фосфат натрия не вступают в реакцию ионного обмена, то все четыре вида ионов будут находиться в смешанном растворе, но при этом их концентрации уменьшились вдвое:
С1(К+)=С1(Cl-)=С1(Na+)=0, 02моль/л; С1(РО43-)=0, 06 моль/л
3. Согласно определению ионной силы раствора:
I=0, 5*(0, 02*1+0, 02*1+0, 02*1+0, 06*9)=0, 3
5.Рассчитать растворимость в моль/л и г/л, если известны значения произведений растворимости: Кs(Са3(PО4)2 = 2, 0*10-29
Решение
1.Составим выражение для ПР:
Кs=С(Са2+)3*С(РО43-)2
2.Пусть растворимость соли = х моль/л, тогда Ks=(3x)3*(2x)2=108x5, тогда х=1, 8*10-6 моль/л
3. Р(Г/л)=1, 8*10-6*310=0, 00056г/л
6. Рассчитайте растворимость фосфата серебра (моль/л и г/л), если его произведение растворимости 1, 3 * 10-20
|
|